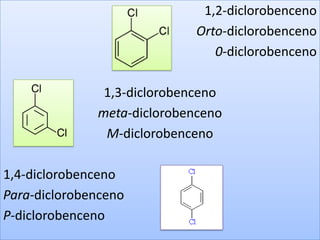
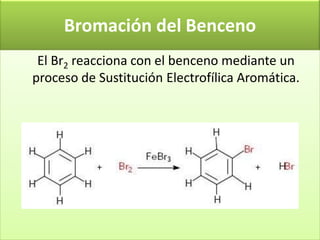
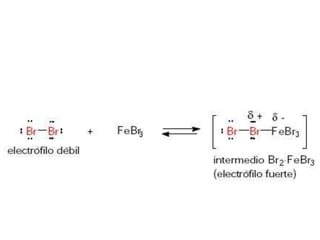
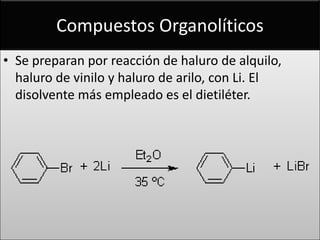
Este documento describe los haluros de arilo, compuestos que contienen uno o más átomos de halógeno unidos al anillo bencénico. Explica su nomenclatura, propiedades, métodos de preparación como la halogenación del benceno y sus reacciones, incluyendo la formación de compuestos organometálicos y sustitución electrofílica aromática. También menciona la baja reactividad de la sustitución nucleofílica aromática en estos compuestos.