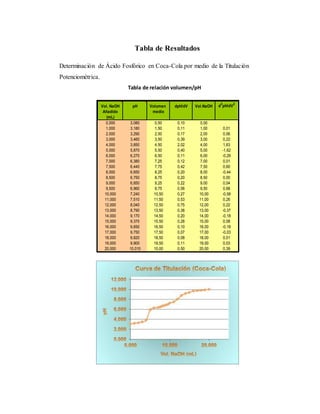
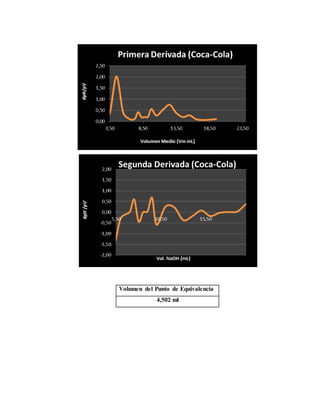
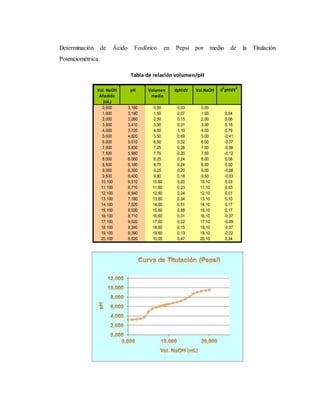
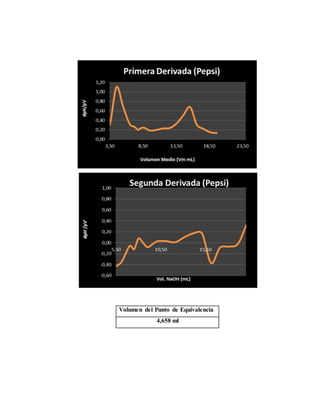
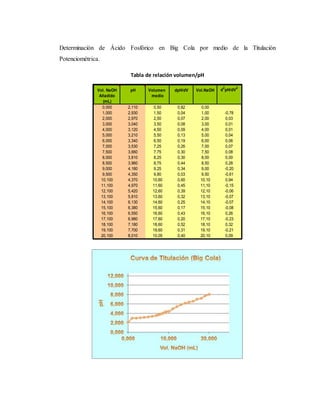
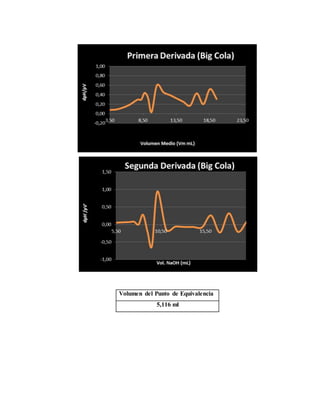
El documento detalla un experimento de titulación potenciométrica para determinar la concentración de ácido fosfórico en refrescos de cola, utilizando un electrodo de membrana para medir variaciones de pH al agregar NaOH como valorante. Se analizan marcas como Coca-Cola, Pepsi y Big Cola, y se reporta la concentración de ácido fosfórico como 42.5 mg/100ml en Coca-Cola, 59.78 mg/100ml en Pepsi y 65.66 mg/100ml en Big Cola, junto con un análisis de errores relativos en las mediciones. La titulación permitió identificar el primer punto de equivalencia, facilitando el cálculo de concentraciones mediante la evaluación de cambios en el pH a partir del uso de gráficas y derivadas.