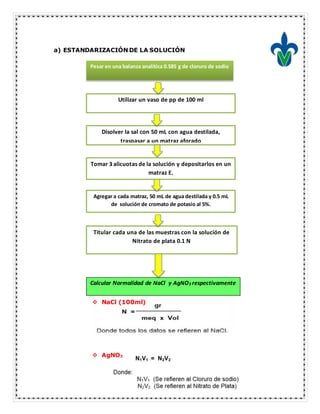
El documento detalla los fundamentos y métodos de la argentometría, específicamente la valoración por precipitación, incluyendo técnicas como el método de Mohr, Volhard, Fajans, y Gay-Lussac. Se abordaron las preparaciones de soluciones estándar, los tipos de indicadores y medidas de seguridad al trabajar con sales de plata. Además, se documentaron conclusiones de estudiantes sobre sus aprendizajes y la correcta ejecución del experimento.