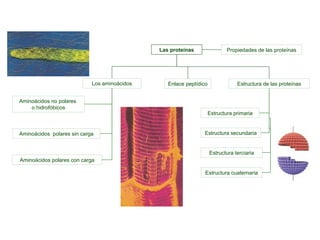
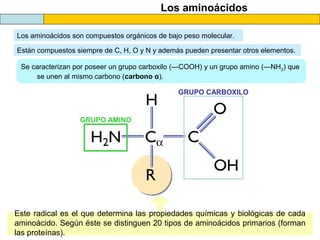
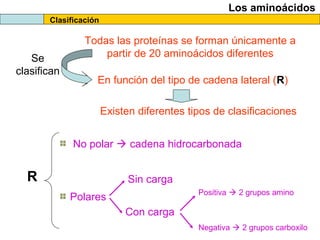
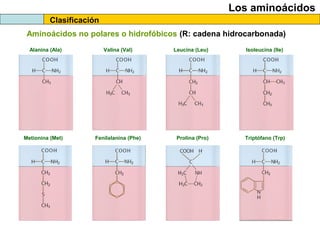
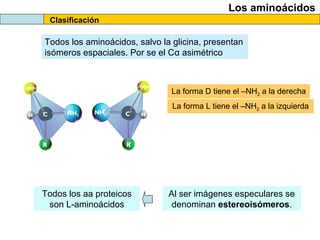
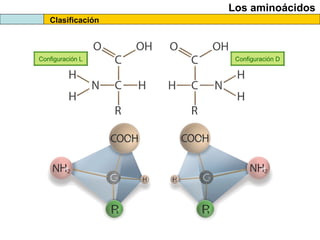
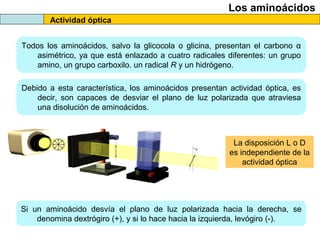
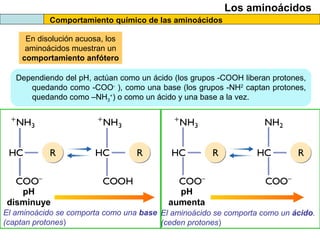
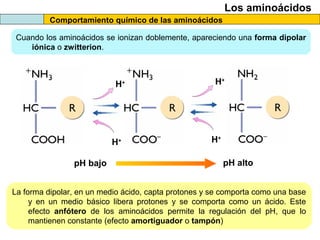
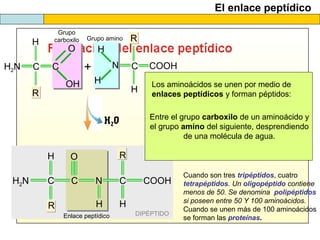
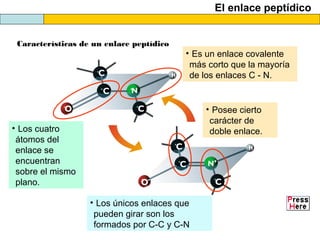
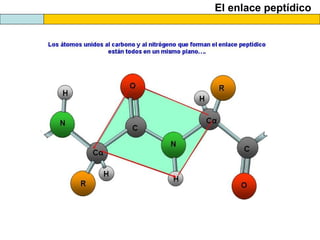
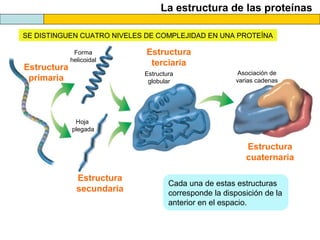
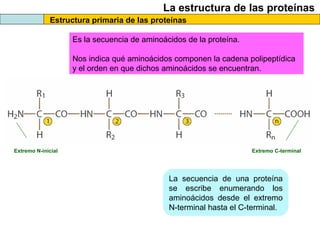
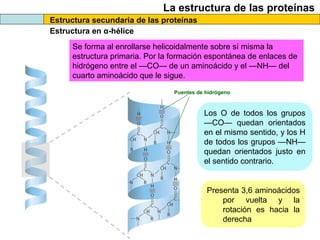
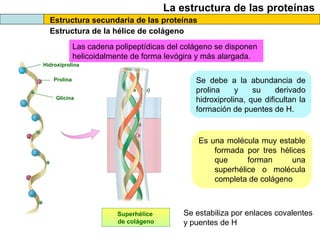
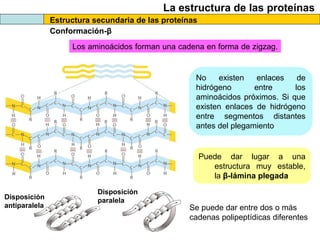
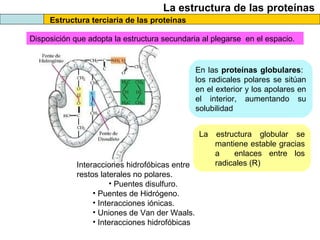
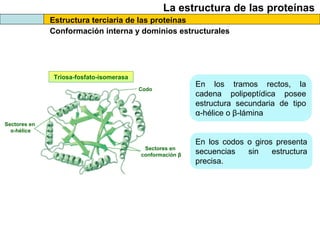
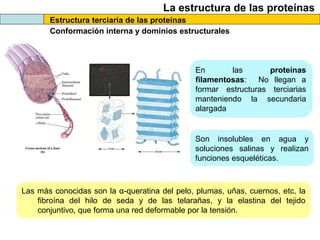
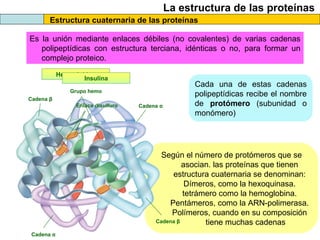
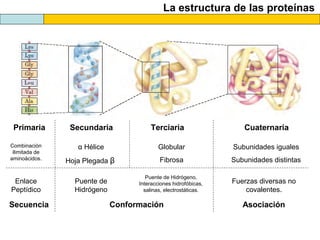
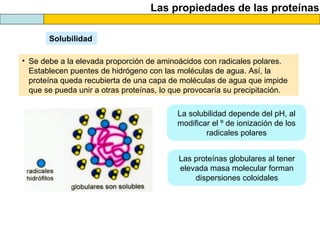
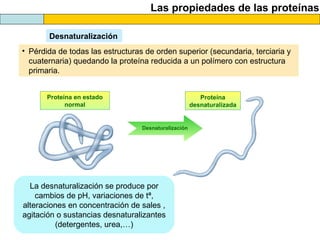
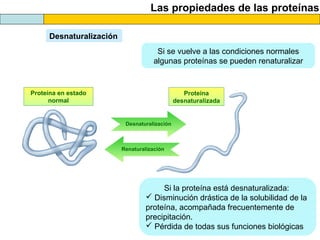
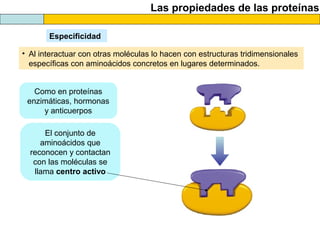
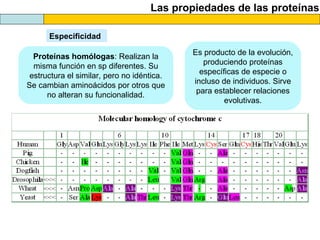
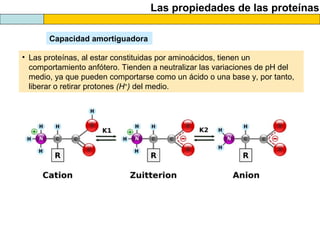
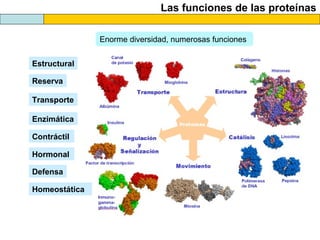
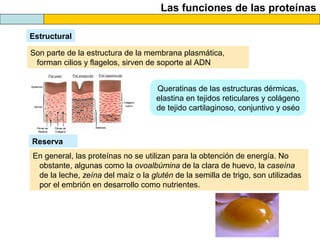
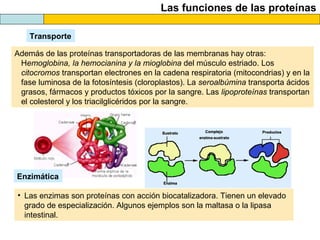
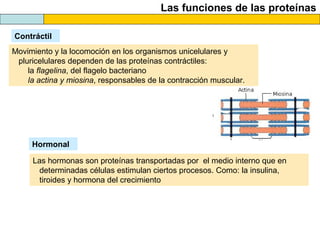
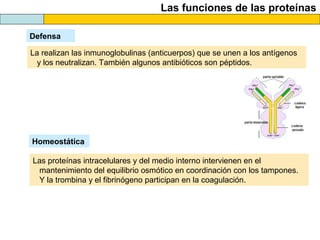
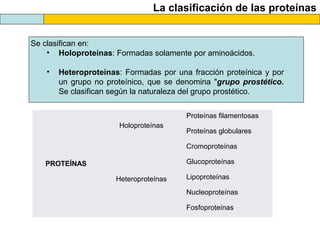
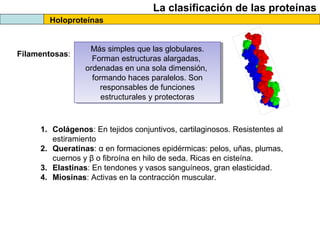
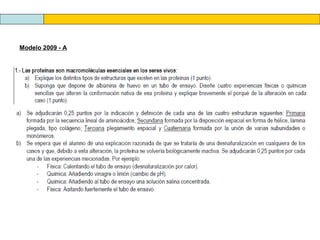
El documento proporciona información sobre las proteínas que suelen aparecer en las pruebas de la PAU. Se destaca que no es necesario conocer las fórmulas de los 20 aminoácidos pero sí identificarlos. También conviene saber ejemplos de cada grupo de aminoácidos y su código de letras, así como identificar el enlace peptídico. Además, se enumeran los temas más comunes que se suelen preguntar sobre las proteínas.