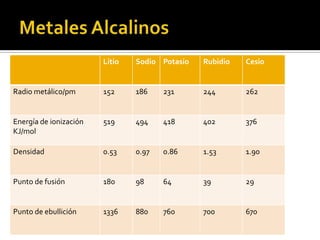
Los metales alcalinos incluyen litio, sodio, potasio, rubidio, cesio y francio. No se encuentran en estado libre en la naturaleza debido a su gran reactividad, especialmente el sodio y el potasio. Forman sales como la sal común y son importantes en la industria, agricultura y como metales alcalinos en baterías y aleaciones livianas.