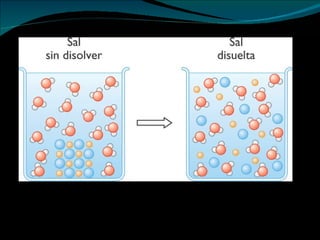
Este documento define y clasifica los diferentes tipos de materia, incluyendo materia homogénea, heterogénea, elementos, compuestos, mezclas homogéneas, mezclas heterogéneas, coloides y disoluciones. También describe las propiedades de estas sustancias y mezclas, y los factores que afectan la solubilidad de las sustancias.