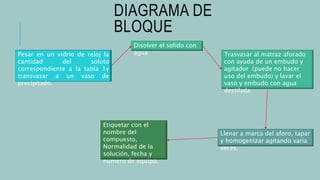
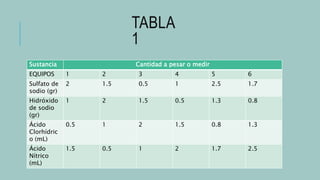
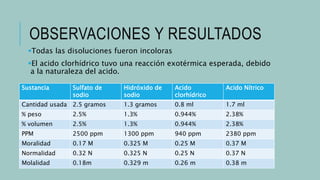
Este documento describe cómo preparar soluciones de concentración determinada. Explica que el componente mayoritario es el disolvente y el menoritario es el soluto. Luego presenta un diagrama de flujo del proceso que incluye pesar el soluto, disolverlo en agua, trasvasar a un matraz aforado, llenar a la marca y etiquetar con la información relevante. Finalmente muestra una tabla con las cantidades a usar de diferentes sustancias y los resultados obtenidos al preparar las soluciones.