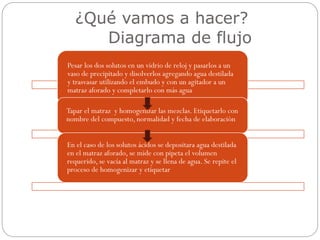
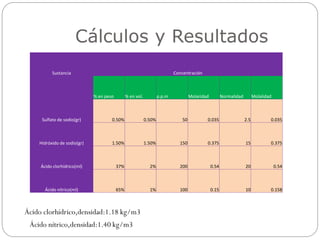
El documento presenta los detalles de una práctica de laboratorio realizada por el Equipo #3 para preparar soluciones de concentración determinada. El equipo pesó dos solutos y los disolvió en agua destilada para transferirlos a matraces aforados y completarlos con más agua. Calculó la concentración de las sustancias en porcentaje en peso, porcentaje en volumen, partes por millón, molaridad y normalidad. Las observaciones indicaron que las mezclas fueron homogéneas sin cambios de color.