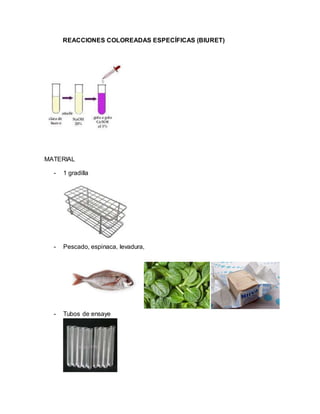
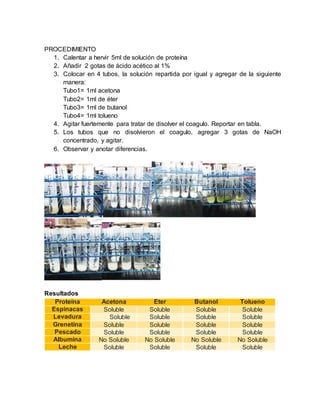
El documento detalla un informe de laboratorio sobre la identificación de proteínas a través de diversas pruebas químicas, incluyendo el uso de reactivos como biuret y ácido clorhídrico. Se realizan experimentos específicos para determinar la presencia y características de diferentes proteínas, destacando la importancia de la precisión en las mediciones. Las conclusiones enfatizan el papel fundamental de las proteínas en el organismo y el enfoque en su aislamiento y análisis.