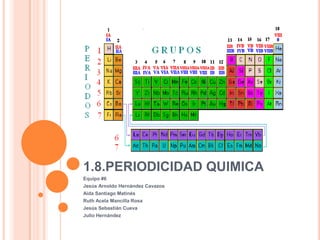
Este documento describe la periodicidad química y la clasificación periódica de los elementos. Explica que los elementos dentro de un mismo grupo de la tabla periódica comparten propiedades similares y clasifica a los elementos en metales, no metales y gases nobles. También describe propiedades atómicas como la carga nuclear efectiva, el radio atómico, la energía de ionización y la electronegatividad, e identifica elementos importantes económica, industrial y ambientalmente como el hidrógeno, oxígeno, oro, plata, antim