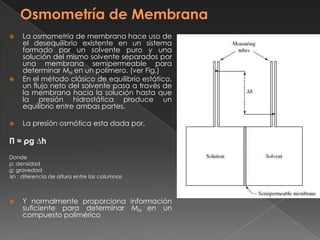
Este documento describe las propiedades coligativas, que dependen del número de moléculas presentes e incluyen elevación del punto de fusión, depresión del punto de congelación y presión osmótica. Estas propiedades se han usado para determinar las masas moleculares de compuestos desconocidos mediante osmometría, crioscopía y ebullimetría. El documento también explica la osmometría de membrana y de fase gaseosa para medir masas moleculares de polímeros.