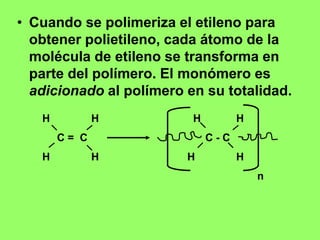
La polimerización por condensación implica la unión de monómeros con la liberación de subproductos pequeños como agua o HCl. En la formación de polímeros como el nylon 6,6 o el PET, los monómeros pierden átomos como cloro o hidrógeno durante la polimerización.