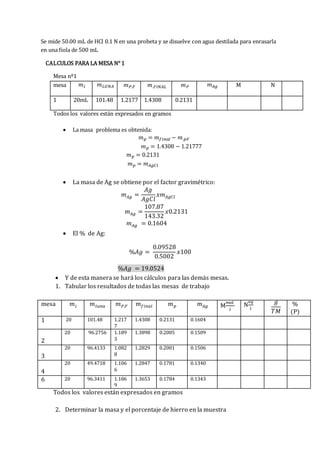
Este documento describe la determinación gravimétrica de plata como cloruro de plata. Primero se presentan los objetivos y fundamentos teóricos de este método. Luego, se detallan los materiales, reactivos y el procedimiento experimental que involucra precipitar la plata como cloruro de plata usando ácido clorhídrico y calcular el porcentaje de plata en la muestra basado en la masa del precipitado. Finalmente, se incluyen cálculos, observaciones y preguntas sobre este método analítico.