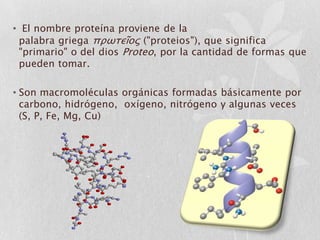
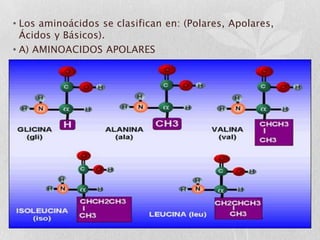
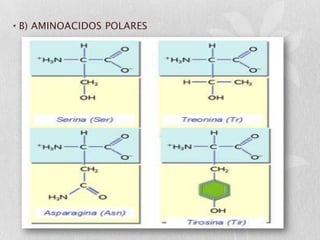
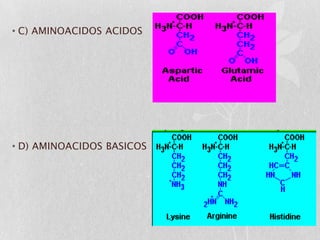
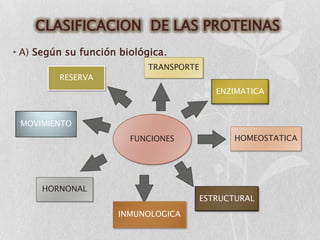
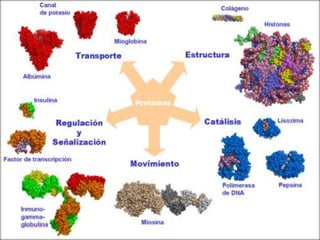
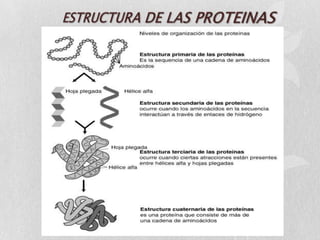
Las proteínas son macromoléculas orgánicas formadas por aminoácidos. Están compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno y a veces otros elementos como azufre, fósforo, hierro y magnesio. Cumplen funciones estructurales, enzimáticas, de transporte y hormonales en el cuerpo. Las proteínas se clasifican según su función biológica, forma y composición química.