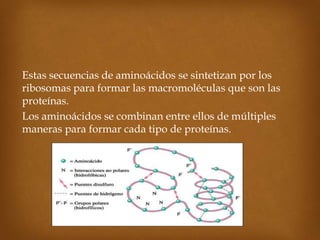
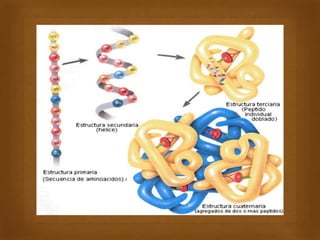
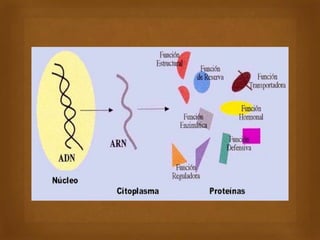
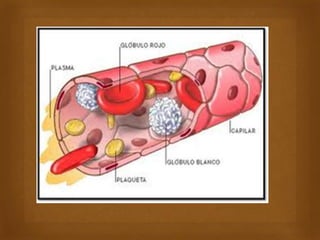
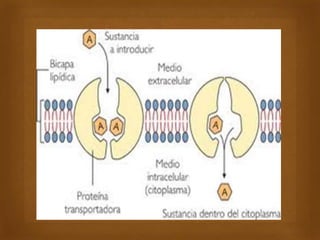
Las proteínas son macromoléculas importantes formadas por aminoácidos que cumplen múltiples funciones en el cuerpo como estructurales, enzimáticas y de transporte. Poseen una estructura primaria, secundaria, terciaria y en algunos casos cuaternaria. Algunos alimentos ricos en proteínas son la carne, los huevos, la leche, la soja y los cacahuetes. Ejemplos de proteínas incluyen el colágeno, la albúmina y los anticuerpos.