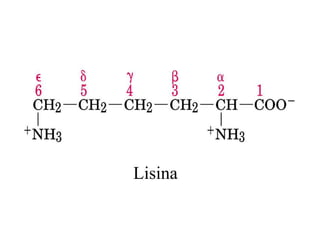
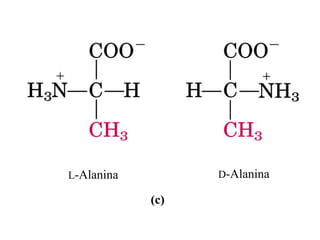
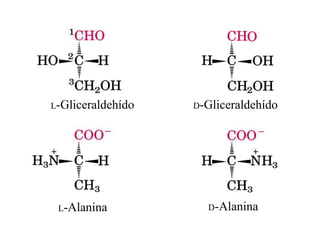
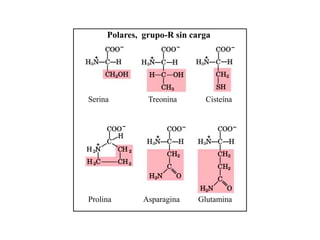
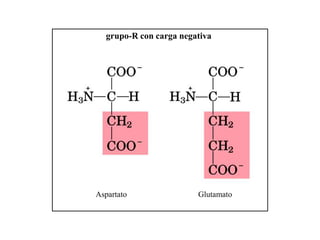
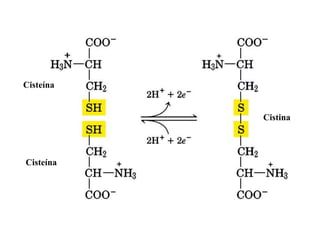
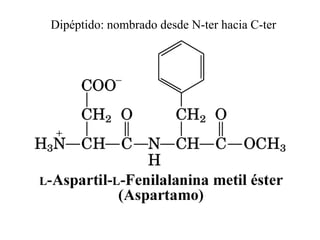
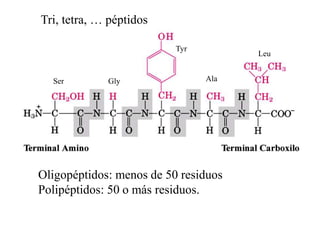
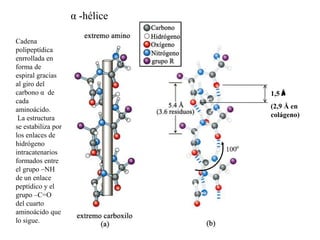
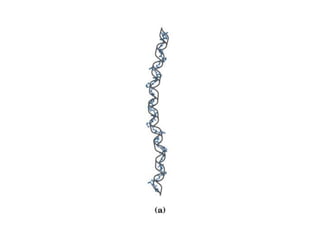
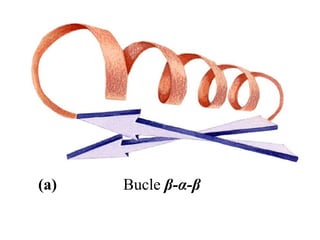
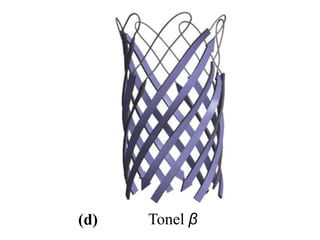
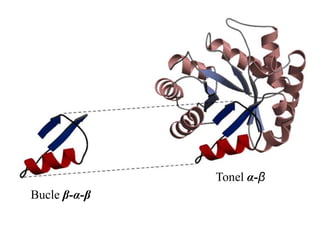
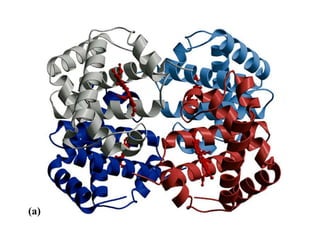
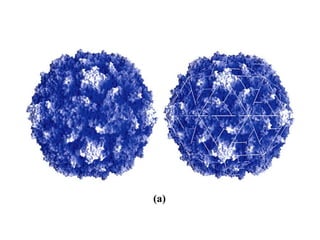
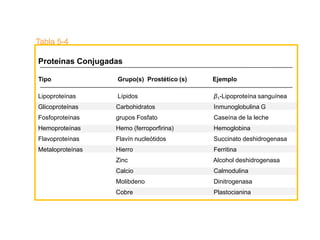
El documento presenta información sobre los aminoácidos comunes que componen las proteínas. Se clasifican los 20 aminoácidos estándar en grupos basados en las propiedades de sus cadenas laterales, como no polares, polares con carga positiva o negativa. También se describen características como el punto isoeléctrico y la hidrofobicidad de cada uno. Se explican conceptos como la estructura primaria, secundaria, terciaria y cuaternaria de las proteínas, y cómo se forman las estructuras secundarias como