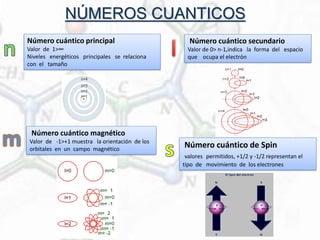
Este documento resume la evolución de los modelos atómicos desde Dalton hasta Dirac, incluyendo los modelos de Thomson, Rutherford, Bohr, Sommerfeld y Schrödinger. Explica los principales conceptos como los números cuánticos, el núcleo atómico, los electrones y sus órbitas, así como la diferencia entre número atómico, masa atómica e isótopos.