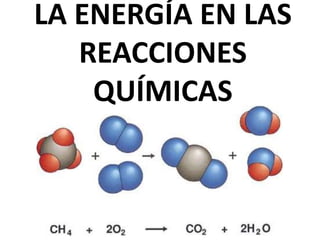
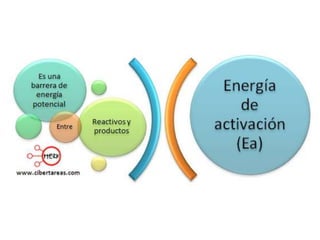
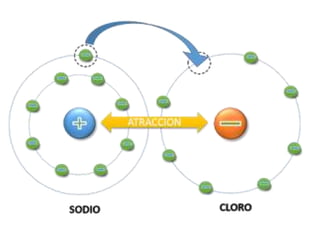
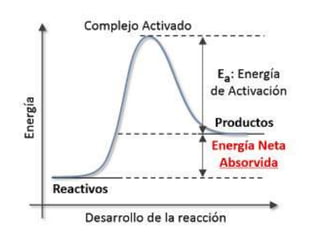
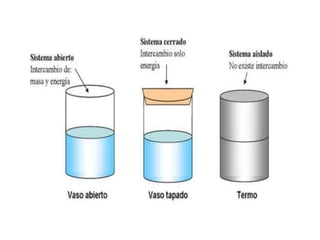
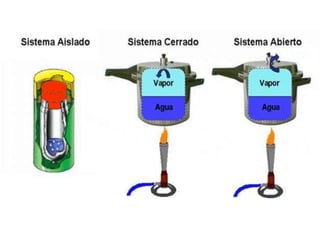
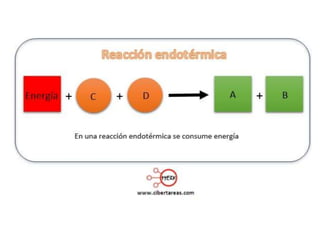
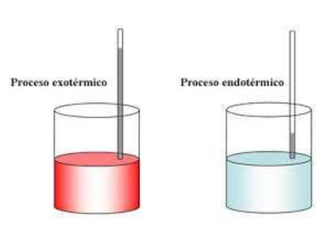
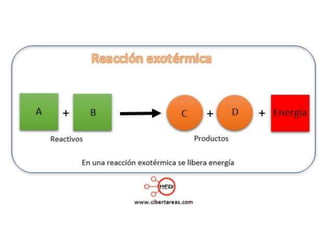
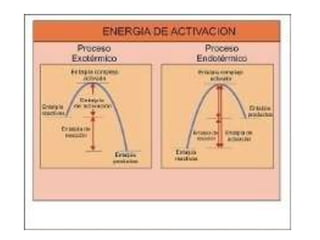
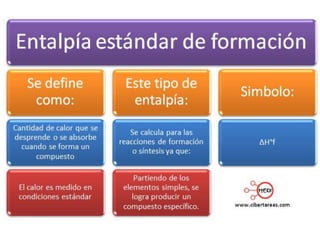
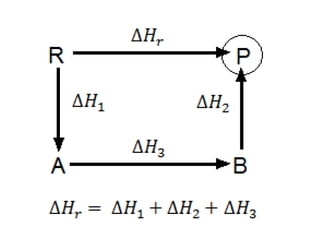
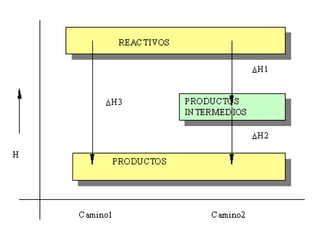
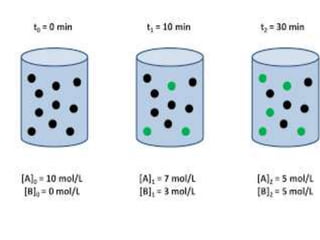
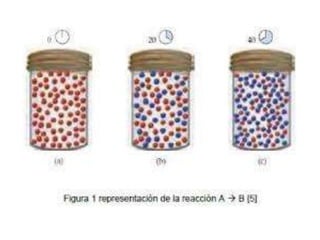
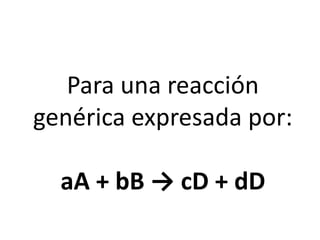
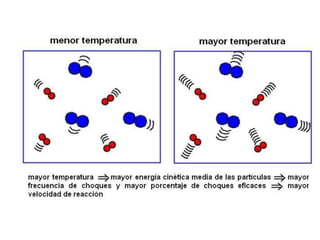
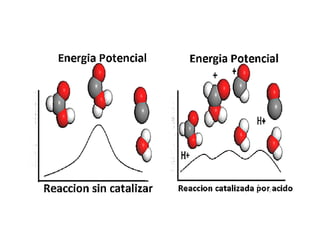
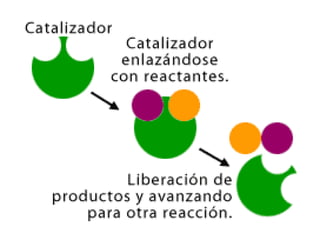
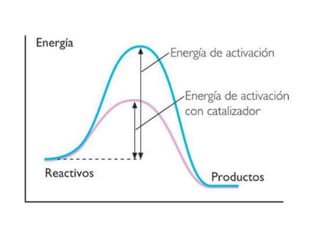
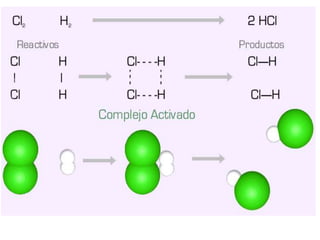
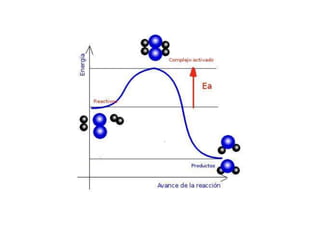
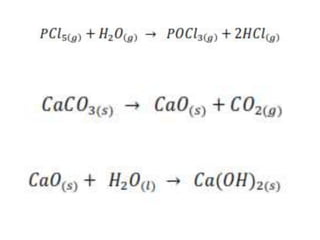1. El documento trata sobre la energía en las reacciones químicas y los factores que afectan la velocidad de reacción. 2. Explica conceptos como la energía de enlace, la energía de activación, y cómo factores como la temperatura, presión y concentración afectan la velocidad de reacción. 3. También discute los tipos de enlaces químicos y reacciones, y el papel de los catalizadores en acelerar las reacciones químicas.