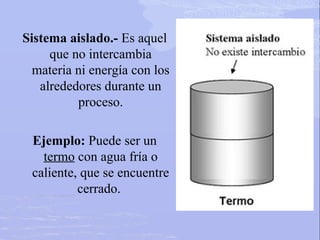
Este documento trata sobre los procesos asociados con el calor y la velocidad de las reacciones químicas. Explica que durante una reacción química los enlaces entre átomos se rompen y se forman nuevos enlaces, absorbiéndose o liberándose energía en forma de calor. También define la termoquímica como la rama que estudia los cambios de calor en las reacciones, y describe los diferentes tipos de sistemas y cómo las reacciones pueden ser endotérmicas u exotérmic