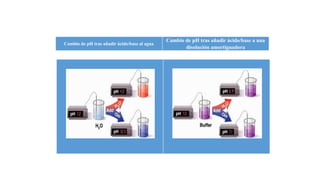
El documento describe los principios de las soluciones amortiguadoras y cómo responden al agregar ácidos o bases. Explica que 1) el pH de una solución amortiguadora depende de la naturaleza del ácido débil que contiene, 2) el pH depende de la proporción relativa entre la sal y el ácido, no de sus concentraciones absolutas, y 3) la modificación del pH es exigua hasta que uno de los componentes se agote debido a que el pH varía con el logaritmo de la proporción entre la sal y el

![La concentración de
protones del agua pura
Una elevación inmediata
Se añade una mínima
cantidad de un ácido
cualquiera.
Experimenta
Cuando
Supongamos que al acetato
sódico (sal de ácido débil y base
fuerte) le añadimos un ácido
fuerte como el HCl se produce un
aumento instantáneo de la [H+], y
el equilibrio se desplaza hacia la
izquierda, formándose AcH hasta
recuperarse prácticamente la
[AcH] inicial. Además, los iones
acetato procedentes de la sal se
pueden combinar con los
H+ procedentes del HCl para
formar más AcH.](https://image.slidesharecdn.com/quimica-160111002444/85/Quimica-3-320.jpg)



![Es un proceso generalizado, en el cual compuestos complejos,
sales u otras moléculas se ven separadas en moléculas de
menos tamaño, ya sean estas iones o radicales, generalmente
de manera reversible.
Para entender el proceso de disociación, se hace
necesario el uso de una constante de equilibrio,
conocida como constante de disociación, la cual
se representa con la letra Kc.
Cuando tratamos disociaciones de
tipo reversibles en un equilibrio
químico, obedecemos al esquema
siguiente:
AB ↔ A + B, así para
dicho equilibrio, la
constante se representará
como :
Kc = ( [A].[B]) / [AB], o lo que
es lo mismo, la constante de
disociación para un equilibrio
químico será igual a
multiplicar las
concentraciones de los
productos, dividido por la
concentración de los
reactivos.
Cuando tratamos la disociación de sales,
debemos tener en cuenta la solvatación, es
decir, el proceso donde se asocian las moléculas
de un disolvente con las moléculas del soluto (o
iones de soluto), lo que hace que cuando se
disuelvan dichos iones en un solvente X, estas se
dispersen, siendo seguidamente rodeadas por
distintas moléculas de solvente.](https://image.slidesharecdn.com/quimica-160111002444/85/Quimica-7-320.jpg)