Este documento describe las disoluciones reguladoras, que pueden mantener el pH constante a pesar de la adición de ácidos o bases. Estas disoluciones contienen una mezcla de un ácido débil y su sal conjugada, o una base débil y su ácido conjugado. En los seres vivos, pequeñas variaciones de pH pueden dañar las enzimas y proteínas, mientras que en la industria es importante mantener un pH fijo durante procesos y fabricación. El documento también explica cómo calcular el pH de una disolución regul


![En los seres vivos:
Variaciones muy pequeñas en [H3O+] de las células
pueden desactivar las encimas, alterar las proteínas o
impedir el desarrollo de procesos vitales en los
organismos.
Principales tampones fisiológicos: Fosfato,
bicarbonato, hemoglobina
DISOLUCIONES REGULADORAS
En la industria:
Agrícola, alimentaria , farmacéutica, etc. Asegurar
el pH fijo de sustratos, procesos de fabricación y
productos finales.
Aplicación, mantener fijo el pH:](https://image.slidesharecdn.com/disolucionesreguladoras-160402114921/85/Disoluciones-reguladoras-3-320.jpg)



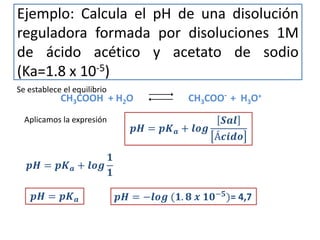
![Cálculo del pH de una disolución reguladora
Ejemplo: ác. acético/ acetato Se establece el equilibrio
CH3COOH + H2O CH3COO- + H3O+
Ka =
CH3COO− ∙ H3O+
CH3COOH
[CH3COOH]eq = Concentración inicial de ácido
[CH3COO-]eq = Concentración inicial de sal
Ka =
Sal ∙ H3O+
Ácido
Despejando: H3O+
=
𝐾 𝑎 Ácido
Sal
Tomando logaritmos: log H3O+ = log (Ka) + log
Ácido
Sal
Cambiando el signo: -log H3O+
= −log (Ka) − log
Ácido
Sal
𝒑𝑯 = 𝒑𝑲 𝒂 + 𝒍𝒐𝒈
𝑺𝒂𝒍
Á𝒄𝒊𝒅𝒐
𝒑𝑯 = 𝒑𝑲 𝒂](https://image.slidesharecdn.com/disolucionesreguladoras-160402114921/85/Disoluciones-reguladoras-7-320.jpg)
![Cálculo del pH de una disolución reguladora
Ejemplo: ion amonio/ amoniaco Se establece el equilibrio
Kb =
N𝐻4
+
∙ O𝐻−
NH3
[NH3]eq = Concentración inicial de base
[NH4
+]eq = Concentración inicial de sal
Kb =
Sal ∙ OH−
Base
Despejando: OH−
=
𝐾𝑏 Base
Sal
Tomando logaritmos: log OH− = log (K 𝑏) + log
Base
Sal
Cambiando el signo: -log OH− = −log (K 𝑏) − log
𝐵𝑎𝑠e
Sal
𝒑𝑶𝑯 = 𝒑𝑲 𝒃 + 𝒍𝒐𝒈
𝑺𝒂𝒍
𝑩𝒂𝒔𝒆
NH3 + H2O NH4
+ + OH-](https://image.slidesharecdn.com/disolucionesreguladoras-160402114921/85/Disoluciones-reguladoras-8-320.jpg)