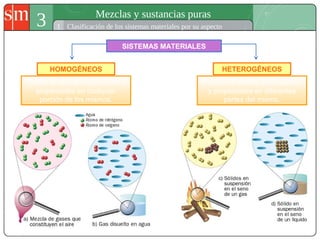
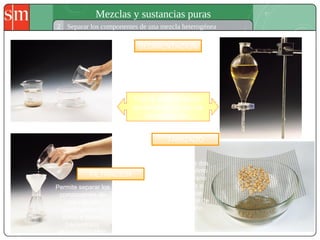
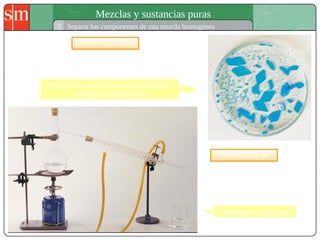
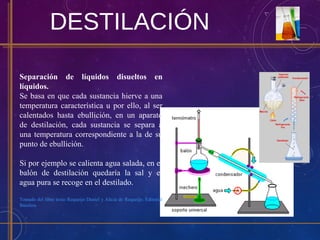
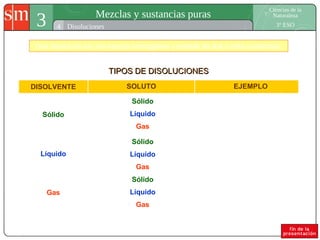
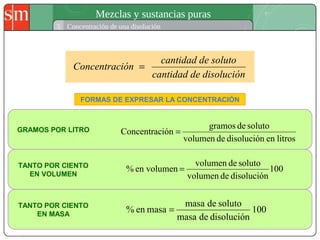
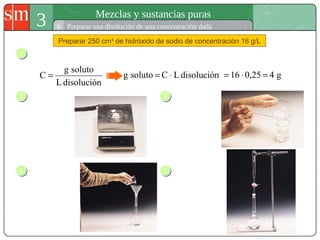
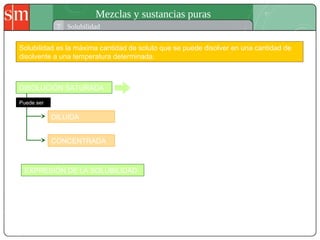
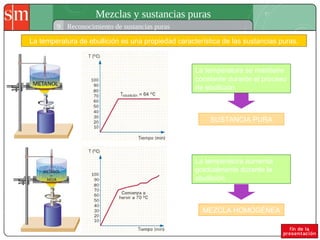
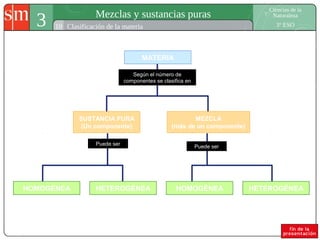
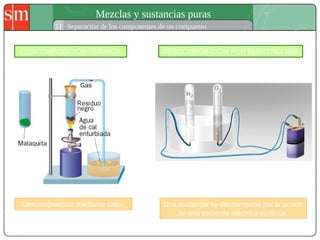
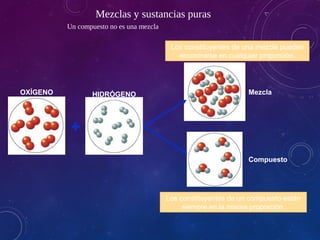
Este documento describe diferentes tipos de sistemas materiales, incluyendo sustancias puras, mezclas homogéneas, mezclas heterogéneas y disoluciones. Explica cómo clasificar los sistemas materiales según su aspecto y composición, así como métodos para separar los componentes de mezclas heterogéneas y homogéneas.