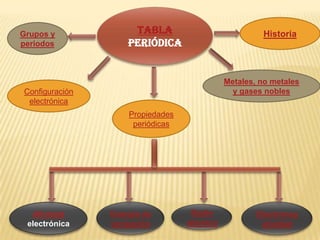
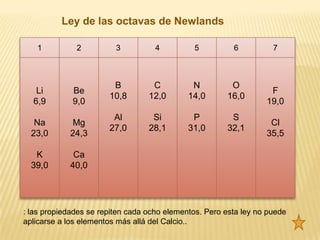
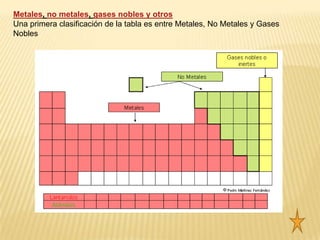
El documento resume brevemente la historia del desarrollo del sistema periódico desde las primeras clasificaciones de elementos en grupos hasta la versión moderna ordenada por número atómico. Explica las propiedades de los metales, no metales y gases nobles, y describe algunas propiedades periódicas clave como el radio atómico, la energía de ionización y la electronegatividad.