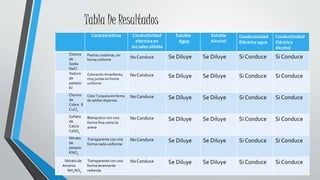
Este documento describe un experimento de laboratorio para determinar la conductividad eléctrica de varias sales en estado sólido y disuelto. Se midió la capacidad de conducir electricidad de sales como NaCl, KI, CuCl2 y otras tanto en su forma sólida como después de disolverse en agua u alcohol. Los resultados mostraron que las sales no conducen en estado sólido pero sí lo hacen una vez disueltas, confirmando la hipótesis planteada.