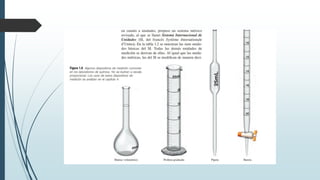
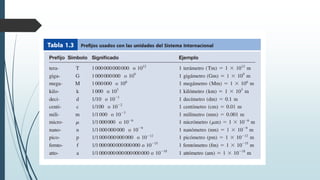
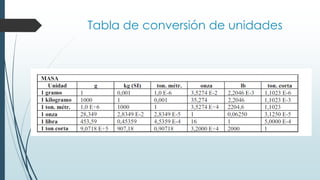
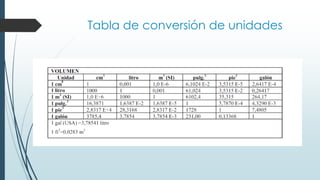
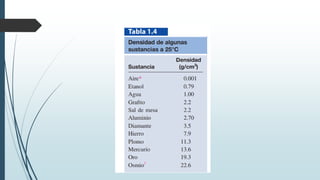
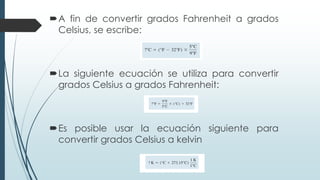
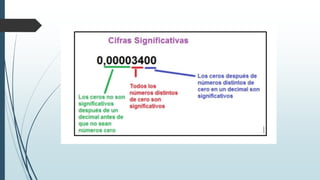
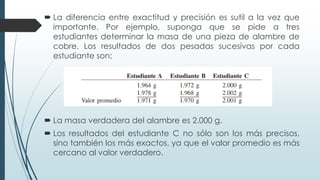
Este documento trata sobre mediciones fundamentales en química. Explica las unidades del Sistema Internacional para medir propiedades como masa, volumen, temperatura y densidad. También cubre conceptos como notación científica y cifras significativas para expresar números grandes y pequeños en química.