1º_2º_3º Ley de la termodinámica.ppt
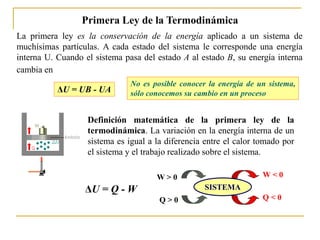
- 1. Primera Ley de la Termodinámica La primera ley es la conservación de la energía aplicado a un sistema de muchísimas partículas. A cada estado del sistema le corresponde una energía interna U. Cuando el sistema pasa del estado A al estado B, su energía interna cambia en Definición matemática de la primera ley de la termodinámica. La variación en la energía interna de un sistema es igual a la diferencia entre el calor tomado por el sistema y el trabajo realizado sobre el sistema. ΔU = Q - W SISTEMA Q > 0 W > 0 W < 0 Q < 0 No es posible conocer la energía de un sistema, sólo conocemos su cambio en un proceso ΔU = UB - UA
- 2. ΔU = función de estado extensiva Q y W no son funciones de estado. Ya que conociendo los estados inicial y final no se puede conocer Q o W Tanto Q como W dependen del camino seguido para ir del estado 1 al estado 2 ΔU = Q - W Ejemplo: Si tomamos 1 mol de H2O a 25 ºC y 1 atm, y elevamos la temperatura hasta 30 ºC, siendo la presión final 1 atm. ¿Cuánto vale Q? No se puede calcular Q, ya que el proceso no está especificado. Se podría aumentar la T, Q = mCpΔT = 18g x 1cal/(g ºC) x 5ºC = 90 cal Pero ¿cómo se eleva la temperatura? U ≡ f (T,P,V)
- 3. Calor y el trabajo se “distinguen” por su efecto sobre las moléculas del entorno Q W • Ambas son formas de variar la energía del sistema • El calor es energía “desordenada” y el trabajo energía “ordenada” • NO son funciones de estado
- 4. ΔU= Q - W Proceso cíclico ΔU = 0 W = Q Proceso no es cíclico ΔU ≠ 0 Proceso a volumen constante ΔU = Q Proceso aislado ΔU = W Si el sistema realiza trabajo U disminuye Si se realiza trabajo sobre el sistema U aumenta. Si el sistema absorbe calor al ponerlo en contacto térmico con un foco a temperatura superior, U aumenta Si el sistema cede calor al ponerlo en contacto térmico con un foco a una temperatura inferior, U disminuye. SISTEMA Q > 0 W > 0 W < 0 Q < 0
- 5. • En un sistema adiabático, la energía interna sólo puede cambiar por transferencia de trabajo con el entorno. ΔU = Q - W •En un sistema diatérmico, la energía interna puede cambiar por transferencia de calor y trabajo con el entorno. ΔU = Q - W
- 6. Transformaciones La energía interna U del sistema depende únicamente del estado del sistema, en un gas ideal depende solamente de su temperatura. Mientras que la transferencia de calor o el trabajo mecánico dependen del tipo de transformación o camino seguido para ir del estado inicial al final. - No hay variación de volumen del gas - W = 0 - Q = nCv(TB - TA) - Donde Cv es el calor específico a volumen constante Proceso Isócorico - ΔU = Q - W = Q - PΔV
- 7. Proceso Isóbarico - No hay variación en la presión del gas - W = p(VB - VA) - Q = nCp(TB - TA) - Donde Cp es el calor específico a presión constante - ΔU = Q - W = Q - PΔV
- 8. p V - No hay variación en la temperatura del gas - ΔU = ΔQ - ΔW - Si ΔU = 0 (proceso isotérmico) Entonces 0 = ΔQ - ΔW Por lo tanto, ΔQ = ΔW Proceso Isotérmico Para un gas ideal, la energía interna es independiente del volumen, sólo depende de la temperatura. En consecuencia para cualquier proceso isotermo en un gas ideal U = 0
- 9. Proceso Definición Consecuencia de la 1ra Ley Adiabático Q = 0 U = W Isocórico W = 0 U = Q Cíclico U = 0 Q = W Procesos Específicos y la Primera Ley
- 10. Respuesta: (a) W es el trabajo hecho por el sistema. Es el negativo del trabajo que se hace sobre el sistema. Así que W = - 200J. (b) Q es el calor que se extrae del sistema. Así que Q = - 70 cal = - 70 * 4.19 J = - 293.3J (c) U = Q - W = -293.3 – (- 200) = -293.3 + 200 = - 93.3J EJEMPLO: En un determinado proceso se hacen 200 J de trabajo sobre un sistema durante el cuál se extraen 70 cal de calor. Calcule (a) W, (b) Q y (c) U con sus signos.
- 11. • Función de estado H ≡ f (T,P,V,U) • Propiedad extensiva • Unidades de energía (J) • H ≡ H [J/mol] n ENTALPÍA (H) H ≡ U + PV La entalpía es el calor absorbido o liberado en un proceso a presión constante
- 12. PROCESO A PRESIÓN CONSTANTE ΔU = Q - W = Q − ∫ Pext dV = QP - P ∫ dV = QP – P (V2-V1) ΔU=U2 - U1 V2 V1 QP = ΔU + P (V2-V1) QP = (U2 + PV2) - (U1+ PV1) = ΔH A presión constante ΔH2 ΔH1
- 13. Reactivos Entalpia (H) Productos H > 0 Reac. endotérmica Entalpia (H) Reactivos Productos H < 0 Reac. exotérmica Exotérmico: calor liberado por el sistema Endotérmico: calor absorbido por el sistema
- 14. Proceso exotérmico es cualquier proceso que cede calor, es decir, transfiere energía térmica hacia los alrededores. Proceso endotérmico, en el cual los alrededores deben suministrar calor al sistema. 2H2 (g) + O2 (g) 2H2O (l) + energía H2O (g) H2O (l) + energía energía + 2HgO (s) 2Hg (l) + O2 (g)
- 15. Relación Qv con Qp (gases) H = U + P · V Aplicando la ecuación de los gases: P · V = n · R · T y si P y T son constantes la ecuación se cumplirá para los estados inicial y final: P · V = n · R · T H = U + n · R · T
- 16. EJEMPLO: Determinar la variación de energía interna para el proceso de combustión de 1 mol de propano a 25ºC y 1 atm, si la variación de entalpía, en estas condiciones, vale – 2219,8 kJ. C3H8 (g) + 5 O2 (g) 3 CO2 (g) + 4 H2O (l) H = –2219,8 kJ Mol reactivos = 1+5 = 6 Mol productos = 3 n = 3-6=-3 H = U + n · R · T Despejando en U = H – n · R · T = – 2219*103 J + 3 mol · (8,3 J/mol.K) · 298 K = –2214*10+3J U = – 2212 kJ
- 17. Relación Qv con Qp (sólidos y líquidos) En reacciones de sólidos y líquidos apenas se produce variación de volumen y ... Qv Qp es decir: U H
- 18. Entalpía Normal de la Reacción Es el incremento entálpico de una reacción en la cual, tanto reactivos como productos están en condiciones estándar (P = 1 atm; T = Cte) Se expresa como H0 y como se mide en J o kJ depende de cómo se ajuste la reacción. Así, H0 de la reacción “2 H2 + O2 2 H2O” es el doble del de “H2 + ½ O2 H2O”. H0 = H0productos – H0reactivos
- 19. Ecuaciones Termoquímicas Expresan tanto los reactivos como los productos indicando entre paréntesis su estado físico, y a continuación la variación energética expresada como H (habitualmente como H0). Ejemplos: CH4(g) + 2 O2(g) CO2(g) + 2 H2O(l) Hº = –890 kJ H2(g) + ½ O2(g) H2O(g) Hº = –244,4 kJ
- 20. Ecuaciones Termoquímicas ¡CUIDADO!: H depende del número de moles que se forman o producen. Por tanto, si se ajusta poniendo coeficientes dobles, habrá que multiplicar Hº por 2: 2 H2(g) + O2(g) 2 H2O(g) Hº = 2· (–241,4 kJ) Con frecuencia, suelen usarse coeficientes fraccionarios para ajustar las ecuaciones: H2(g) + ½ O2(g) H2O(g) Hº = –241,4 kJ
- 21. H2O (s) H2O (l) Δ H = 6.01 kJ • Los estados físicos de todos los reactivos y productos se deben especificar en las ecuaciones termoquímicas. Ecuaciones Termoquímicas H2O (l) H2O (g) Δ H = 44.0 kJ ¿Cuánto calor se libera cuando 266 g de fósforo blanco (P4) se queman en el aire? P4 (s) + 5O2 (g) P4O10 (s) ΔH = -3013 kJ Respuesta ΔH = - 6470 kJ
- 22. ¿Cuánto calor se emite cuándo una barra de hierro de 869 g se enfría de 94°C a 5°C? Ce de Fe = 0.444 J/g • 0C Δt = tfinal – tinicial = 50C – 940C = -890C Q = mCeΔt= 869 g x 0.444 J/g • 0C x –890C = -34339,4 J
- 23. Entalpía estándar de formación (calor de formación). Es el incremento entálpico (H) que se produce en la reacción de formación de un mol de un determinado compuesto a partir de los elementos en estado físico normal (en condiciones estándar). Se expresa como Hºf. Se trata de un “calor molar”, es decir, el cociente entre Hº y el número de moles formados de producto. Por tanto, se mide en kJ/mol. Ejemplos: C(s) + O2(g) CO2(g) Hfº = – 393,13 kJ/mol H2(g) + ½ O2(g) H2O(l) Hfº = – 285,8 kJ/mol
- 24. Cálculo de Hº (calor de reacción) Aplicando la ley de Hess podemos concluir que : Hº = npHºf (productos)– nrHºf(reactivos) Recuerda que Hºf de todos los elementos en estado original es 0.
- 25. EJEMPLO: Conocidas las entalpías estándar de formación del butano (C4H10), agua líquida y CO2, cuyos valores son respectivamente –124,7; –285,8 y –393,5 kJ/mol, calcular la entalpía estándar de combustión. del butano. La reacción de combustión del butano es: C4H10(g) +13/2O2(g) 4 CO2(g) + 5H2O(l) Hºcomb= ? Hº = npHºf(product.) – nrHºf(reactivos) = 4mol(– 393,5 kJ/mol) + 5mol(– 285,8 kJ/mol) – 1mol(– 124,7 kJ/mol) = – 2878,3 kJ/mol Luego la entalpía estándar de combustión será: Hºcombustión = – 2878,3 kJ/mol
- 26. Ley de Hess - Cuando los reactivos se convierten en productos, el cambio en entalpía es el mismo independientemente si la reacción tiene lugar en un paso o en una serie de pasos . - - Recuerda que H es función de estado. - Por tanto, si una ecuación química se puede expresar como combinación lineal de otras, podremos igualmente calcular H de la reacción global combinando las H de cada una de las reacciones.
- 27. Ejemplo: Dadas las reacciones (1) H2(g) + ½ O2(g) H2O(g) Hº1 = – 241,8 kJ (2) H2(g) + ½ O2(g) H2O(l) Hº2 = – 285,8 kJ Calcular la entalpía de vaporización del agua en condiciones estándar. Hºvap = + 44 kJ (1) H2(g) + ½ O2(g) H2O(g) Hº1 = – 241,8 kJ (2) H2O(l) H2(g) + ½ O2(g) Hº2 = + 285,8 kJ H2O(l) H2O(g)
- 28. Esquema de la ley de Hess Hº1 = – 241,8 kJ Hº2 = – 285,8 kJ Hº3 = 44 kJ H H2(g) + ½ O2(g) H2O(g) H2O(l)
- 29. Ejercicio: Conocidas las entalpías estándar de formación del butano (C4H10), agua líquida y CO2, cuyos valores son respectivamente –124,7, –285,8 y –393,5 kJ/mol, calcular la entalpía estándar de combustión del butano. Si utilizamos la ley de Hess, la reacción: (4) C4H10(g) +13/2O2(g) 4 CO2(g) + 5H2O(l) H0comb=? Puede obtenerse a partir de: (1) H2(g) + ½ O2(g) H2O(l) Hº1 = – 285,8 kJ (2) C(s) + O2(g) CO2(g) Hº2 = – 393,5 kJ (3) 4C(s) + 5H2(g) C4H10(g) Hº3 = – 124,7 kJ ΔHºcomb = – 2878,3 kJ
- 30. Ejercicio: Determinar Hºf del eteno (C2H4) a partir de los calores de reacción de las siguientes reacciones químicas: (1) H2(g) + ½ O2(g) H2O(l) Hº1 = – 285,8 kJ (2) C(s) + O2(g) CO2(g) Hº2 = – 393,13 kJ (3) C2H4(g) + 3O2(g) 2CO2(g) + 2 H2O(l) Hº3 = – 1422 kJ ΔHºf = 64,14 kJ
- 31. Ejercicio: Las entalpías de combustión de la glucosa (C6H12O6) y del etanol (C2H5OH) son –2815 kJ/mol y –1372 kJ/mol, respectivamente. Con estos datos determina la energía intercambiada en la fermentación de un mol de glucosa, reacción en la que se produce etanol y CO2. ¿Es exotérmica la reacción? Las reacciones de combustión son, respectivamente: (1) C6H12O6 + 6O2 6CO2 + 6H2O H1 = – 2815 kJ/mol (2) C2H5OH + 3O2 2CO2 + 3H2O H2 = – 1372 kJ/mol
- 32. Calcule la entalpía estándar de formación de CS2 (l) teniendo que: C(grafito) + O2 (g) CO2 (g) ΔH0= -393.5 kJ S(rómbico) + O2 (g) SO2 (g) Δ H0= -296.1 kJ CS2(l) + 3O2 (g) CO2 (g) + 2SO2 (g) Δ H0 = -1072 kJ ΔH0 = 86.3 kJ
- 33. Entropía (S) Es una medida del desorden del sistema que sí puede medirse y tabularse. S = Sfinal – Sinicial Existen tablas de Sº (entropía molar estándar) de diferentes sustancias. En una reacción química: Sº = np· Sºproductos – nr· Sºreactivos La entropía es una función de estado.
- 34. Segunda Ley de la Termodinámica “En cualquier proceso espontáneo la entropía total del universo tiende a aumentar siempre” Suniverso = Ssistema + Sentorno 0 A veces el sistema pierde entropía (se ordena) espontáneamente. En dichos casos el entorno se desordena. La entropía se define: dS = dQ / T La entropía es el criterio de espontaneidad y equilibrio en sistemas aislados (volumen y energía interna constantes). Este criterio se aplica de la siguiente manera: a) si la entropía del universo aumenta, el proceso es espontáneo; b) si la entropía del universo disminuye, el proceso no es espontáneo; c) si la entropía del universo permanece constante, el sistema se encuentra en equilibrio.
- 35. La entropía (S) es una medida de la aleatoriedad o desorden de un sistema. orden S desorden S ΔS = Sf - Si Si el cambio de los resultados de inicial a final es un aumento en la aleatoriedad Sf > Si ΔS > 0 Para cualquier sustancia, el estado sólido es más ordenado que el estado líquido y el estado líquido es más ordenado que el estado gaseoso Ssólido< Slliquido<< Sgas H2O (s) H2O (l) ΔS > 0
- 36. Procesos que conducen a un aumento en la entropía (ΔS > 0) Sólido Líquido Líquido Soluto Disolución Disolvente Sistema a T1 Sistema a T2 (T2 > T1)
- 37. ¿Cómo cambia la entropía de un sistema para cada uno de los procesos siguientes? (a) Condensación de vapor de agua La aleatoriedad disminuye La entropía disminuye (ΔS < 0) (b) Formación de cristales de sacarosa de una disolución sobresaturada La aleatoriedad disminuye La entropía disminuye (ΔS < 0) (c) Calentamiento de hidrógeno gaseoso desde 600C a 800C La aleatoriedad aumenta La entropía aumenta (ΔS > 0) (d) Sublimación del hielo seco La aleatoriedad aumenta La entropía aumenta (ΔS > 0)
- 38. ejemplo: Un mol de gas ideal realiza una expansión isotérmica de 20 MPa a 1 MPa . La temperatura es de 398.15 K. Calcular el cambio de entropía para el gas, los alrededores y el total, a) si el proceso es reversible. b) si es irreversible.
- 40. Ejercicio: Cinco moles de nitrógeno son enfriados reversiblemente desde 1000 °K hasta 300 °K. Calcular el cambio de entropía para el sistema, para los alrededores y el total considerando que depende de la temperatura, Cv. a) Si el proceso se realiza a volumen constante b) Si el proceso se realiza a presión constante Dato:
- 41. Cambios de entropía en el sistema (ΔSsis) aA + bB cC + dD ΔS0 rx dS0(D) cS0(C) = [ + ] - bS0(B) aS0(A) [ + ] ΔS0 rx nS0(productos) = S mS0(reactivos) S - La entropía estándar de una reacción (ΔS0 rx) es el cambio de la entropía para una reacción.
- 42. ¿Cuál es el cambio en la entropía estándar en la siguiente reacción a 250C? 2CO (g) + O2 (g) 2CO2 (g) S0(CO) = 197.9 J/K•mol S0(O2) = 205.0 J/K•mol S0(CO2) = 213.6 J/K•mol ΔS0 rxn = 2 x S0(CO2) – [2 x S0(CO) + S0 (O2)] ΔS0 rxn = 427.2 – [395.8 + 205.0] = -173.6 J/K•mol
- 43. Cambios de entropía en el sistema (ΔSsis) Cuando los gases son producidos (o consumidos) • Si una reacción produce más moléculas de gas que las que consume, ΔS0 > 0. • Si el número total de moléculas disminuye, ΔS0 < 0. • Si ni hay cambio neto en el número total de moléculas de gas , entonces ΔS0 puede ser positivo o negativo PERO ΔS0 será un número pequeño. ¿Cuál es el signo del cambio de la entropía para la reacción siguiente? 2Zn (s) + O2 (g) 2ZnO (s) El número total de moléculas de gas baja , ΔS es negativo .
- 44. Cambios de entropía en los alrededores (ΔSalred) Proceso exotérmico ΔSalred > 0 Proceso endotérmico ΔSalred < 0 Alrededores Alrededores Sistema Sistema Calor
- 45. Ejemplo: Calcula Sº para las siguientes reacciones químicas: a) N2(g) + O2(g) 2 NO(g); b) 3 H2(g) + N2(g) 2 NH3(g). Datos: Sº (J·mol–1·K–1): H2(g) = 130,6; O2(g) =205; N2(g) = 191,5; NO(g) = 210,7; NH3(g) =192,3 Sº = np· Sºproductos – nr· Sºreactivos a) Sº = 2 mol · 210,7 J ·mol–1 ·K–1 – (191,5 J·K–1 + 205 J·K–1 ) = 24,9 J·K–1 b) Sº = 2·192,3 J·K–1 – (3 mol ·130,6 J· mol–1·K–1 + 191,5 J·K–1 ) = –198,7 J·K–1
- 46. ΔSuniverso = Δ Ssistema + Δ Salrededor > 0 Proceso espontáneo: ΔSuniverso = ΔSsistema + ΔSalrededor = 0 Proceso en equilibrio:
- 47. Física espontánea y procesos químicos • Una cascada corre cuesta abajo • Un terrón de azúcar se disuelve en una taza de café •El calor fluye de un objeto más caliente a un objeto más frío • Un gas se expande en una bombilla al vacío • El hierro expuesto al oxígeno y agua forma herrumbre espontáneo no espontáneo
- 49. ¿Una disminución en el entalpía significa que una reacción procede espontáneamente? CH4 (g) + 2O2 (g) CO2 (g) + 2H2O (l) H0 = -890.4 kJ H+ (ac) + OH- (ac) H2O (l) H0 = -56.2 kJ H2O (s) H2O (l) H0 = 6.01 kJ NH4NO3 (s) NH4 +(ac) + NO3 - (ac) H0 = 25 kJ H2O Reacciones espontáneas
- 50. “La entropía de cualquier sustancia a 0 K es igual a 0” (máximo orden). Equivale a decir que no se puede bajar de dicha temperatura. ¡CUIDADO! Las S de los elementos en condiciones estándar no son 0 sino que es positiva. Tercera Ley de la Termodinámica
- 51. Energía libre de Gibbs (G) (energía libre o entalpía libre) En procesos a T constante se define como: G = H – T · S G = H – T · S En condiciones estándar: Gº = Hº – T· Sº Suniverso = Ssistema + Sentorno > 0 (p. espontáneos) Multiplicando por “–T” y como “–T Sentorno = Hsist” –T · Suniverso = – T · Ssist + Hsist = G < 0 En procesos espontáneos: G < 0 Si G. > 0 la reacción no es espontánea Si G. = 0 el sistema está en equilibrio
- 52. Incremento de energía libre de una reacción (G) - G es una función de estado. - Al igual que el incremento entálpico el incremento de energía libre de una reacción puede obtenerse a partir de Gºf de reactivos y productos: Gº = np Gºf (productos) – nr Gºf (reactivos)
- 53. Reactivos Energía libre (G) Productos G > 0 Energía libre (G) Reactivos Productos G < 0 T, p = ctes. T, p = ctes. Reac. no espontánea Energía libre y Espontaneidad de las Reacciones Químicas Reac. Espontánea
- 54. No siempre las reacciones exotérmicas son espontáneas. Hay reacciones endotérmicas espontáneas: Evaporación de líquidos. Disolución de sales... Ejemplos de reacciones endotérmicas espontáneas: NH4Cl(s) NH4 +(aq) + Cl– (aq) Hº = 14,7 kJ H2O(l) H2O(g) Hº = 44,0 kJ Espontaneidad en las Reacciones Químicas
- 55. Una reacción es espontánea cuando G = H – T S es negativo. Según sean positivos o negativos los valores de H y S (T siempre es positiva) se cumplirá que: H < 0 y S > 0 G < 0 Espontánea H > 0 y S < 0 G > 0 No espontánea H < 0 y S < 0 G < 0 a T bajas G > 0 a T altas H > 0 y S > 0 G < 0 a T altas G > 0 a T bajas Espontaneidad en las Reacciones Químicas
- 56. H > 0 S > 0 Espontánea a temperaturas altas H < 0 S > 0 Espontánea a todas las temperaturas H < 0 S < 0 Espontánea a temperaturas bajas H > 0 S < 0 No Espontánea a cualquier temperaturas H S Espontaneidad en las Reacciones Químicas
- 57. Ejemplo: ¿Será o no espontánea la siguiente reacción en condiciones estándar? 2H2O2(l) 2H2O (l) + O2(g) Datos: Hºf (kJ/mol) H2O(l) = –285,8; H2O2(l) = –187,8 ; Sº (J/·mol K) H2O(l) = 69,9; H2O2(l) = 109,6; O2(g) =205,0. Hº = npHfº(productos)– nrHfº(reactivos) = Hº = 2 Hfº(H2O) + Hfº(O2) – 2 Hfº(H2O2) = 2 mol(–285,8 kJ/mol) – 2 mol(–187,8 kJ/mol) = –196,0 kJ Sº = np· Sºproductos – nr· Sºreactivos = Sº = 2Sº(H2O) + Sº(O2) – 2Sº(H2O2) = 2 mol(69,9 J/mol·K) + 1 mol(205, J/mol·K) – 2mol(109,6 J/mol·K) = 126,0 J / K = 0,126 kJ / K Gº = Hº – T · Sº = –196,0 kJ – 298 K · 0,126 kJ/ K = Gº = – 233,5 kJ luego será espontánea
- 59. 5.- 6.- 7.- 8.-
- 60. 9.-
- 61. 10.-
- 62. 11.-