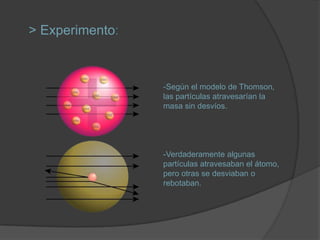
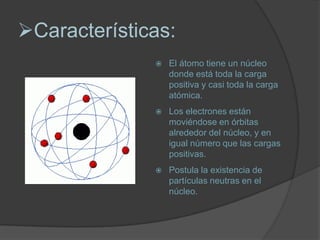
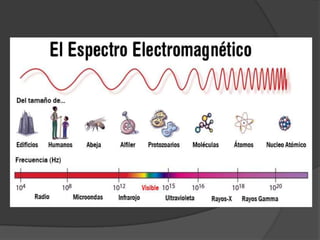
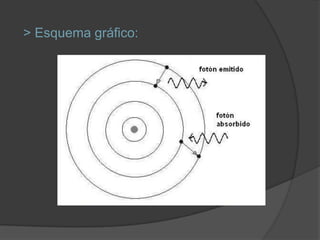
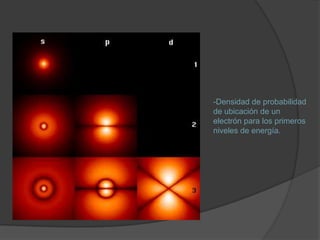
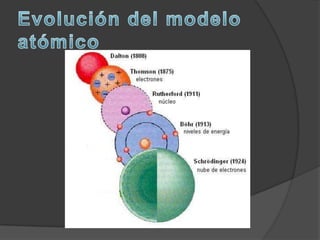
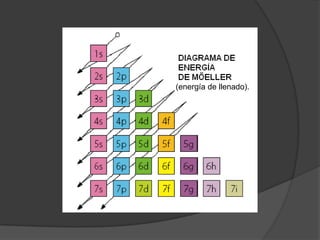
La materia está compuesta de átomos, las unidades más pequeñas de materia. Los átomos están formados por un núcleo central con protones y neutrones, rodeado de electrones. A principios del siglo XX, experimentos como el de Rutherford mostraron que el átomo tiene una estructura con la mayor parte de su masa concentrada en un núcleo minúsculo. Esto llevó al desarrollo de modelos atómicos como el de Bohr, donde los electrones orbitan en niveles de energía cuantizados alrededor del núcle