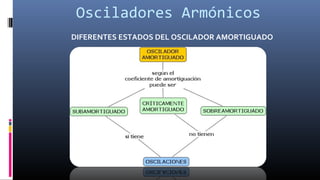
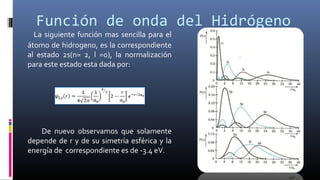
El documento aborda el desarrollo de la teoría cuántica, comenzando con las contribuciones de Max Planck y Albert Einstein en la comprensión de la radiación del cuerpo negro y el efecto fotoeléctrico. Se discuten las ideas de Niels Bohr sobre la estructura atómica y la dualidad onda-partícula propuesta por Louis de Broglie, junto con los fundamentos de la mecánica cuántica y ejemplos relevantes como el modelo del átomo de hidrógeno y el efecto Zeeman. Finalmente, se resaltan los distintos estados y propiedades de los osciladores armónicos en física.