Principales parásitos en Peces
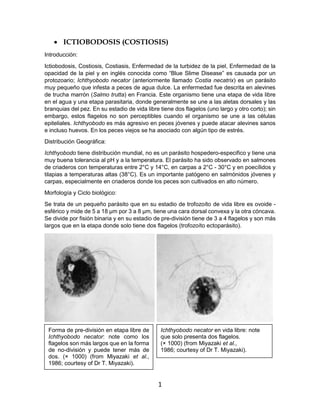
- 1. 1 • ICTIOBODOSIS (COSTIOSIS) Introducción: Ictiobodosis, Costiosis, Costiasis, Enfermedad de la turbidez de la piel, Enfermedad de la opacidad de la piel y en inglés conocida como “Blue Slime Disease” es causada por un protozoario; Ichthyobodo necator (anteriormente llamado Costia necatrix) es un parásito muy pequeño que infesta a peces de agua dulce. La enfermedad fue descrita en alevines de trucha marrón (Salmo trutta) en Francia. Este organismo tiene una etapa de vida libre en el agua y una etapa parasitaria, donde generalmente se une a las aletas dorsales y las branquias del pez. En su estadio de vida libre tiene dos flagelos (uno largo y otro corto); sin embargo, estos flagelos no son perceptibles cuando el organismo se une a las células epiteliales. Ichthyobodo es más agresivo en peces jóvenes y puede atacar alevines sanos e incluso huevos. En los peces viejos se ha asociado con algún tipo de estrés. Distribución Geográfica: Ichthyobodo tiene distribución mundial, no es un parásito hospedero-especifico y tiene una muy buena tolerancia al pH y a la temperatura. El parásito ha sido observado en salmones de criaderos con temperaturas entre 2°C y 14°C, en carpas a 2°C - 30°C y en poecílidos y tilapias a temperaturas altas (38°C). Es un importante patógeno en salmónidos jóvenes y carpas, especialmente en criaderos donde los peces son cultivados en alto número. Morfología y Ciclo biológico: Se trata de un pequeño parásito que en su estadio de trofozoíto de vida libre es ovoide - esférico y mide de 5 a 18 µm por 3 a 8 µm, tiene una cara dorsal convexa y la otra cóncava. Se divide por fisión binaria y en su estadio de pre-división tiene de 3 a 4 flagelos y son más largos que en la etapa donde solo tiene dos flagelos (trofozoíto ectoparásito). Forma de pre-división en etapa libre de Ichthyobodo necator: note como los flagelos son más largos que en la forma de no-división y puede tener más de dos. (× 1000) (from Miyazaki et al., 1986; courtesy of Dr T. Miyazaki). Ichthyobodo necator en vida libre: note que solo presenta dos flagelos. (× 1000) (from Miyazaki et al., 1986; courtesy of Dr T. Miyazaki).
- 2. 2 El núcleo es de redondo a oval, y los gránulos basófilos a menudo se observan en el citoplasma, El cuerpo basófilo es largo como la base del flagelo. En su etapa parasitaria se alarga y se adhiere a una célula huésped por su extremo anterior puntiagudo. Tavolga y Nigrelli (1947) sugirieron que el flagelado también tiene una etapa saprófaga, que se adhiere y se alimenta de células y escamas separadas. La membrana celular consta de dos capas membranosas con una capa fibrilar entre ellas. Las nueve fibrillas periféricas de los flagelos continúan formando el complejo kinetoplasto-mitocondria. La membrana nuclear también tiene dos capas y hay un solo nucléolo. Tiene un órgano de adhesión llamado disco plano que la presentan los trofozoítos de vida libre. La infección ocurre cuando las formas de vida libre se adhieren a un pez. Tanto las fases de vida libre como parasitarias se multiplican por fisión longitudinal binaria. Los peces comienzan a presentar signos una o dos semanas después de la infección, Algunos autores aseguran que las formas de vida libre y las parasitarias se enquistan bajo condiciones ambientales adversas. Los quistes en el agua se convierten en una fuente adicional de infección y contribuyen a la propagación del organismo a nuevas áreas. Este organismo se ha encontrado en las huevas de carpas reproductoras. Otras fuentes de infección son los suministros de agua y peces “salvajes” que entran en un criadero. Las larvas de anfibios (salamandra, rana) también se consideran fuentes potenciales de infección. Hospederos susceptibles: Los peces desnutridos y/o jóvenes se ven afectados más severamente que los adultos sanos, se presenta una alta mortalidad (40-73%) que es asociada con infecciones graves. Los factores importantes que contribuyen a los brotes de enfermedades incluyen el estrés en los peces debido a la transferencia de un estanque a otro y una temperatura alta en el estanque, lo que promueve a una multiplicación más rápida del parásito. Los peces cola de espada (Xiphophorus helleri) son muy susceptibles y generalmente mueren a los 8-14 días después de la infección, mientras que el pez platy (Platypeocilus maculatus) son menos susceptibles. La tilapia (Tilapia macrocephala) y los guppies (Poecilia reticulata) tienen infecciones ligeras o las infecciones se limitan a la región caudal. Generalmente se asume que se adquiere cierta inmunidad protectora en la recuperación de una infección. Signos clínicos: Los peces con infecciones relativamente leves en el cuerpo se frotan contra objetos sumergidos o con los lados del tanque, también pueden presentar un signo denominado “flashing” que se presenta cuando los peces nada rotando alrededor de su eje central o aberrante, por lo que a veces muestran sus abdómenes plateados. Estas actividades son respuestas a las irritaciones de la piel causadas por el parásito. Sin embargo, los peces con infecciones graves a menudo presentan fatiga y anorexia. Aparece manchas en la superficie del cuerpo y se fusionan para formar películas grisáceas en las aletas y la superficie del cuerpo. Además, las branquias suelen estar inflamadas y otros signos clínicos incluyen secreciones mucosas y aletas desgastadas o destruidas. Es posible que algunos peces infectados no puedan mantenerse en posición vertical ni nadar en la
- 3. 3 superficie del agua. Los peces con infecciones de branquias solo se observan fatigados y anoréxicos, pero no presentan el signo de flashing ni tienen exceso de exudado mucoso. Diagnóstico de la infección: Los signos clínicos son generalmente usados para obtener un diagnóstico presuntivo de la enfermedad. La infección es confirmada por la examinación del moco de las branquias y de otras superficies del cuerpo en un microscopio. El parásito es bastante frágil y con frecuencia se rompe durante la fijación y la tinción. Los frotis cuidadosamente preparados (p. ej., de la superficie del cuerpo) generalmente se fijan con fijador de Shaudinn y se transfieren al alcohol etílico antes de teñirse (usando hematoxilina de hierro, carmín, ácido periódico de Schiff). En la actualidad, no existen técnicas serológicas que puedan usarse para detectar la infección o determinar el estado inmunológico de los peces. Se puede usar histopatología para diagnóstico de la enfermedad. Tratamiento: Una aplicación de un tratamiento adecuado por lo general controla la ictiobodosis, pero las infestaciones en las especies eurihalinas pueden ser resistentes al tratamiento con sal. Ichthyobodo parece ser un parásito obligado. El secnidazol, el triclabendazol y el metronidazol parecen ser altamente eficaces como medicamentos orales, pero son demasiado costosos para ser económicamente factibles en las granjas comerciales de peces alimentarios. Se desconoce si las diferentes especies de Ichthyobodo varían en la susceptibilidad a los medicamentos. Con la comprensión de que existen múltiples especies Trucha arcoíris con Ictiobodosis, muestra la típica capa azul-grisácea turbia en la piel. (from Hofer 1904).
- 4. 4 de este parásito, se debe tener cuidado para evitar la introducción de peces infectados con Ichthyobodo en nuevos ambientes. El lavado con formalina (166 ppm) durante 1 hora o un baño de formalina (1: 4000) durante 15-30 minutos es bien tolerado por los alevines de salmón. Control: Para controlar un brote, los estanques con peces infectados se drenan y se agrega cal viva o cloruro de cal antes de repoblar con pescado nuevo o tratado. Otros productos químicos útiles incluyen azul de metileno, permanganato de potasio, aureomicina, globúcido, lisol e hidrocloruro de quinina. Elevar la temperatura del agua a 32 ° C durante 5 días también es efectiva contra las cepas sensibles a la temperatura, pero esto no se recomienda para peces de agua fría.
- 5. 5 • BOTRIOCEFALOSIS Introducción: La tenia asiática, Bothriocephalus acheilognathi, es uno de los cestodos patógenos más importantes en ciprínidos, ya que causa la enfermedad conocida como Botriocefalosis y es uno de los parásitos más peligrosos en la ciprinicultura. El parásito también se ha encontrado en una variedad de otros peces teleósteos de agua dulce, lo que provocó la preocupación de la enfermedad en las poblaciones de peces silvestres. B. acheilognathi ha sido reportado con más de 20 nombres diferentes y los más utilizados son Bothriocephalus gowkongensis y Bothriocephalus opsariichthydis. Según Chubb (1985) y Pool (1987), todas las descripciones de tenias de Bothriocephalus encontrados en carpas representan el mismo parásito, que difieren solo en la longitud y la forma del escólex porque se utilizaron diferentes métodos para identificar el gusano. Distribución geográfica: B. acheilognathi es endémico de Asia oriental, pero se ha extendido rápidamente por todo el mundo con el comercio de peces. El parásito ahora se ha registrado en todos los continentes, sin incluir la Antártida. En México se introdujo en 1965 debido a una importación de carpa china proveniente de China aunado con un mal manejo de la cuarentena. Morfología: Bothriocephalus acheilognathi proveniente del griego: bothrion (invaginación-surco); kephalon (cabeza); a (ausencia); cheilos (labio) y gnathos (mandíbula). B. acheilognathi normalmente mide entre 3.5 y 8 cm de largo y hasta 4 mm de ancho, aunque se han observado especímenes de 60 cm e incluso 1 m. El tamaño es un parámetro morfológico muy variable ya que depende de: I. Las condiciones ecológicas; II. El tamaño del hospedador; III. Las especies hospedadoras; IV. La edad del hospedero; V. La intensidad de la infección. En consecuencia, el tamaño del parásito no es una característica válida sobre la cual basar la identificación, a pesar de las creencias anteriores. Una característica morfológica importante de B. acheilognathi es su escólex en forma de corazón, con un disco apical poco desarrollado y un par de surcos profundos que se encuentran dorsoventralmente a lo largo del escólex. El escólex es mucho más ancho con respecto a los primeros segmentos corporales (proglótidos). La estróbila (cuerpo) de la tenia presenta numerosos proglótidos, cada uno con un conjunto de órganos reproductores. La forma de estos segmentos difiere con la madurez. Los segmentos inmaduros que carecen de órganos genitales completamente desarrollados son siempre más anchos que largos, mientras que los segmentos grávidos más desarrollados que tienen óvulos son rectangulares y más largos que anchos.
- 6. 6 Sin embargo, la contracción y la relajación de los segmentos también causan una variación extrema en la relación de longitud y ancho de la estróbila El sistema reproductor masculino está formado por numerosos testículos esféricos situados en la médula. El sistema reproductivo femenino está compuesto por un ovario bilobulado situado cerca del margen posterior de cada segmento. La vagina, que es corta y ligeramente tortuosa, se abre hacia la aurícula genital común posterior al poro genital masculino. Los folículos vitelinos son muy numerosos, circuncorticales y convergentes entre los segmentos. El útero es sacular, esférico u oval, y se abre en el lado ventral del tercio anterior del segmento. Los huevos son de paredes gruesas, operculados, y generalmente sin embriones cuando se liberan en el agua. Ciclo biológico: B. acheilognathi tiene un ciclo de vida simple de dos hospedadores, que implica un copépodo planctónico como huésped intermedio. En condiciones favorables, el ciclo de vida puede completarse en aproximadamente 1 mes. Los huevos arrojados por parásitos adultos en la luz intestinal se liberan al agua a través de las heces. Dependiendo de la temperatura del agua, se forma un embrión (oncosfera de seis hilos o hexacanto) dentro del huevo en unos pocos días. La larva (coracidio) está rodeada por células ciliadas que permiten su movimiento activo en el agua después de salir del huevo. Varios copépodos son huéspedes intermediarios adecuados tanto en condiciones experimentales como naturales. Estos incluyen especies de Acanthocyclops, Cyclops, Macrocyclops, Megacyclops, Mesocyclops, Thermocyclops y Tropocyclops que se consideran comunes en la mayoría de las aguas dulces en todo el mundo. Después de la ingestión, el coracidio pierde sus cilios y penetra en el intestino dentro de la cavidad corporal donde se desarrolla y cambio de estado de una oncosfera a un plerocercoide. El desarrollo larvario se completa en unas pocas semanas, dependiendo de la temperatura del agua: dentro de 21-23 días a 28-29 °C, pero de 1.5-2 meses a 15-22 °C. El ciclo de vida se completa cuando los peces ingieren copépodos infectados. Una vez establecido en el intestino de un pez susceptible, la producción de huevos puede comenzar en tan solo 20 días.
- 7. 7 Se ha demostrado que la transmisión de parásitos adultos puede ocurrir de peces a peces a través de la depredación por peces piscívoros en las presas infectadas, un fenómeno conocido como transmisión postcíclica. Hay registros de la tenia en un anfibio; Ajolote del lago de Pátzcuaro, Michoacán (Ambystoma dumerilii) encontrado por Garcia-Prieto y Osorio-Sarabia en 1991 aunque estos registros pueden representar solo una infección accidental. Huéspedes definitivos: Los huéspedes más susceptibles de B. acheilognathi son los ciprínidos, especialmente la carpa común y la carpa china. Sin embargo, el parásito ha sido reportado en aproximadamente 200 especies de peces de agua dulce. Sin embargo, la madurez del gusano solo la alcanza en algunas especies de peces. Holmes en 1979 identificó tres clases de huéspedes, en términos de su capacidad para permitir la maduración de los parásitos: I. Huéspedes obligatorios; II. Huéspedes oportunos; III. Huéspedes inadecuados. En los "huéspedes obligatorios", los parásitos generalmente obtienen la madurez completa. En 'hospedadores oportunos', los parásitos pueden ganar la madurez sexual, pero solo se encuentran en pequeñas cantidades, mientras que en los "hospedadores inadecuados" los parásitos pueden establecerse, pero no alcanzan la madurez. Los peces pequeños se infectan con más frecuencia e intensidad con B. acheilognathi que los hospederos grandes. Signos clínicos: Los peces infectados se vuelven lentos y nadan cerca de la superficie del agua. Esto puede ir acompañado con inapetencia, crecimiento lento, pérdida de peso, emaciación y signos de anemia. Los alevines de la carpa, cuando están infectados por las tenias se distienden y se hinchan. En peces muy pequeños, el movimiento de las tenias se puede ver a través de la pared del cuerpo antes de la disección. Patogenia: La patogenia generalmente se divide en dos fases: I. Daño causado por la unión de escólex; B. acheilognathi se adhiere a la pared intestinal por su botria, que engulle los pliegues intestinales. Esto causa compresión del epitelio de la mucosa, necrosis de presión focal y hemorragia. La unión de la tenia provoca una respuesta inflamatoria localizada, con respuesta principalmente de linfocitos. Las lesiones asociadas con el escólex dependen de la fuerza ejercida por la botria. En casos avanzados de la infección, la fijación del escólex puede causar ulceración localizada. La enteritis catarral descamativa y la proliferación de tejido conectivo alrededor del punto de unión de los escólex también se han observado. El escólex de algunos parásitos incluso continuó perforando la pared del intestino hacia la cavidad corporal, así pudiendo migrar hasta el hígado y las gónadas. La fijación del escólex causa un gran daño del intestino, por lo que se puede ver a la histopatología: Destrucción
- 8. 8 de las uniones desmosomales, pérdida del borde intestinal microvelloso, separación y pérdida de enterocitos, liberación de restos de células del huésped en la luz intestinal e infiltración de leucocitos en el área infectada. II. Daño causado por la presencia de la estróbila dentro de la luz intestinal. Los cambios patológicos causados por la estróbila de B. acheilognathi generalmente son más agresivos a los asociados con la unión del escólex. El alcance y la gravedad de este daño pueden variar según el tamaño del huésped, el tamaño del parásito y la intensidad de la infección. En peces pequeños ciprínidos, los cambios patológicos se caracterizan por la distensión del intestino, la compresión de los pliegues intestinales y el adelgazamiento pronunciado de la pared intestinal. En infecciones muy intensas, la distensión severa puede ir acompañada de una pérdida completa de porciones de la pared intestinal, con oclusión del intestino, congestión, compresión, necrosis por presión, adelgazamiento y atrofia de la mucosa. Diagnóstico de la infección: Las infecciones se detectan fácilmente en la necropsia, con la recuperación de tenias completas (seguidas de un examen microscópico del escólex) que se encuentran en el intestino. El examen de la materia fecal puede revelar segmentos separados de tenias adultas o huevos (que poseen un opérculo en el ápice). Tratamiento: El Praziquantel es efectivo en el tratamiento de infecciones por cestodos en adultos. No hay estudios publicados sobre tratamiento contra metacestodos. Los estanques pueden desinfectarse para erradicar el huésped intermedio de la tenia asiática. Prevención y control: La prevención debe ser enfocada para peces de procedencia extranjera, ya que estos se deben tener en cuarentena antes de incluirlos a los estanques con los demás peces. Se debe evitar alimentar a los peces con copépodos vivos debido a que podrían transmitir larvas del parásito. Algunos piscicultores controlan la botriocefalosis secando los estanques anualmente o tratando estanques húmedos con cloruro de calcio (70 kg/ha), hipoclorito de calcio o hidróxido de calcio para matar al huésped intermediario y a su vez tratando a los peces infectados con altihelmínticos.
- 9. 9 • ICTIOPTIRIDOSIS Introducción: Ichthyophthirius multifiliis es un protozoario ciliado que causa la enfermedad conocida como Ictioptiridosis, también conocido como “Ich” o “Enfermedad del punto blanco”. Esta enfermedad es un gran problema para los acuaristas y piscicultores de todo el mundo. La enfermedad del punto blanco es una enfermedad importante de peces ya que es altamente contagiosa y se disemina rápidamente de un pez a otro. Y particularmente se vuelve severa cuando hay una gran población de peces en un estanque. Como muchos protozoarios se reproduce por una simple división, un solo organismo “Ich” puede multiplicare dentro de sus hospederos y crear nuevos parásitos. Este organismo es un parasito obligado lo que significa que no puede sobrevivir si no está un pez presente. Es capaz de producir una alta mortalidad dentro de un periodo de poco tiempo. Un brote de “Ich” representa una situación de emergencia que requiere un tratamiento de inmediato, ya que sin él, la enfermedad causa el 100% de mortalidad. Distribución geográfica: Ich es un parásito prácticamente de distribución mundial de peces. Se han notificado infecciones en todas las regiones donde se cultivan peces, incluidos los trópicos y el subártico, así como en poblaciones de peces salvajes de la mayoría de los continentes. Fouquet describió por primera vez el organismo en Francia en 1876. Se sabe que la propagación de la enfermedad fue debida a la venta de peces, por importación de peces de Uganda a Estados Unidos. Ciclo biológico y etapas parasitarias: Este parásito presenta un ciclo de vida directo que se compone de tres etapas: (I) teronte que es la fase infectante; (II) trofonte; y (iii) tomonte. Todas las etapas son ciliadas y móviles. El teronte es de forma oblonga (piriforme), de aproximadamente 40 pm de longitud, con un distintivo cilio caudal. Cuando el teronte se encuentra con un huésped susceptible, penetra rápidamente en los epitelios superficiales de la piel y las branquias a través de la acción ciliar y el uso del “perforatorium”, una estructura especializada de membrana en la parte anterior de la célula. Además, el teronte es quimiotáctico a los componentes del tejido del pez, incluidas las inmunoglobulinas y el moco. Se ha propuesto que el parásito se acerca y entra en el epitelio de la piel a través de las células caliciformes. Después de la
- 10. 10 entrada en el huésped, el teronte rápidamente (en unos minutos) se diferencia en un trofonte, esto implica la formación de un citostoma funcional y un aparato vestibular. El trofonte cambia de su forma rígida y piriforme a una forma celular polimórfica impulsada por la acción ciliar entre las células epiteliales y dentro de los espacios tisulares creados a medida que se alimenta de la piel y las branquias. El trofonte crece rápidamente, aumentando de tamaño de 200-800 p.m. El parásito permanece en el pez durante un número variable de días, dependiendo de la temperatura del agua ambiente, y otros factores como el estado inmune del pez. Típicamente, a una temperatura de 25 ° C, se alimenta por un período de 5-7 días. El trofonte se desarrolla y crece dentro del epitelio, penetrando no más profundo que a la capa de células germinales basales, que se encuentra inmediatamente adyacente a la dermis subyacente. En la madurez, el parásito abandona al pez, que se desencadena por el volumen, el tamaño, el desarrollo y otros factores desconocidos de la célula. Una vez que abandona al huésped y regresa al agua, el organismo móvil, ahora denominado tomonte, nada durante aproximadamente 1 hora y después se adhiere a cualquier sustrato disponible (por ejemplo, vegetación, material inorgánico y otras superficies) para enquistarse. El tomonte permanece ciliado dentro del quiste. Sufre divisiones celulares simétricas y divisiones nucleares amitóticas a intervalos de aproximadamente 1 h que duplican el número de células hijas, que se llaman tomitas. Estas células se diferencian en terontes infecciosos, que atraviesan la pared del quiste y salen progresivamente a través de las perforaciones. El número de terontes producidos por cada tomonte depende del tamaño de la célula cuando sale del pez y del número de divisiones celulares dentro del quiste. Normalmente, 500-1000 parásitos se producen después de nueve a diez divisiones. El ciclo de vida se completa en aproximadamente 16- 18 h a 22-25 ° C. Huéspedes: Ich parece parasitar a todos los peces de agua dulce. No hay registros de especies con resistencia natural completa. Sin embargo, hay sugerencias de variación en el grado de susceptibilidad entre los peces. Estas variaciones pueden depender de factores tales como antecedentes genéticos, estado fisiológico de los peces, cepas de parásitos y condiciones ambientales. Las epizootias en poblaciones nativas de peces a menudo ocurren en una sola especie de peces. Signos clínicos: Los signos clínicos comunes de la ictioptiridosis son la característica lesiones superficiales blancas ("manchas") a lo largo del cuerpo. Cada punto representa un trofonte en desarrollo dentro de una cápsula o vesícula epitelial. En los casos en que la infección está localizada en las branquias, estas no son visibles. Una respuesta fisiológica temprana a la infección es un aumento en la producción de moco en la superficie. La penetración de la piel por parte de los terontes estimula una mayor cantidad de células secretoras de moco en la epidermis. Un médico cuidadoso puede
- 11. 11 detectar infección antes del desarrollo de lesiones superficiales al notar cambios en el comportamiento de los peces. Inicialmente, los peces infectados nadan más rápido y se frotan contra los objetos. Se vuelven cada vez más letárgicos y finalmente dejan de comer. En infecciones severas hay erosión del epitelio, lo que lleva a la formación de úlceras y la exposición de los tejidos más profundos a la invasión bacteriana y fúngica. Una causa común de invasiones secundarias es el hongo Saprolegnia spp., que aparece como mechones de "pelusa" en la piel. Patogenia: Cuando las condiciones son adecuadas (por ejemplo, temperatura óptima y número suficiente de huéspedes), la población de parásitos aumenta muy rápidamente. Como resultado, los peces están expuestos a muchos parásitos en un corto período de tiempo. La infección por I. multifiliis desencadena la hiperplasia de las células epiteliales de las branquias. Como resultado, los espacios interlaminares branquiales se reducen, lo que limita significativamente el área de superficie disponible para el intercambio de oxígeno. Por lo tanto, las infecciones graves hacen que los peces pierdan oxígeno. Además de ser el sitio primario de captación de oxígeno, las branquias también funcionan tanto en la osmorregulación como en la excreción de desechos nitrogenados. La carpa infectada tiene niveles disminuidos de sodio y magnesio en suero y niveles aumentados de potasio sérico. Altos niveles de urea-amoniaco en nitrógeno y residuos nitrogenados se acumulan en la sangre. El aumento de la producción de moco en las branquias de los peces infectados interfiere con las funciones de osmorregulación ya que el moco de los peces es relativamente impermeable al agua y a los iones. La piel es una barrera importante para la pérdida de iones y para la entrada de agua en los peces, y el edema subepidérmico y la alteración del epitelio provocan un desequilibrio iónico. Finalmente, los peces con infecciones severas están bajo estrés y se ha informado que las reacciones de estrés provocan desequilibrios iónicos séricos. Diagnóstico de la infección: El diagnóstico definitivo de una infección por I. multifiliis se realiza mediante la detección microscópica del parásito en biopsias o tejidos tomados en la necropsia. Para preparar las muestras para el examen microscópico, se deben colocar raspados de piel y moco, pedazos pequeños de laminillas branquiales y/o pequeños recortes de cola en un portaobjetos, se agregan algunas gotas de agua y se coloca un cubreobjetos sobre la muestra. Los tejidos deben tomarse de peces vivos, o tan pronto como sea posible después de la muerte del pez. No es necesario fijar o teñir el tejido. En las preparaciones sin teñir, el trofonte se
- 12. 12 puede observar en los tejidos de la piel y las branquias por lo que se detecta fácilmente con a un aumento 4x-10x. El gran núcleo con forma de "herradura" es un indicador patognomónico de diagnóstico para I. multifiliis. Por lo general, es bastante fácil encontrar el parásito debido a su actividad ciliar y movimiento en el tejido. En los cortes histológicos teñidos con hematoxilina y eosina de la piel y las branquias fijadas con formalina, los parásitos son visibles dentro del epitelio. Tratamiento: La formalina es un tratamiento común. Los peces en acuarios se tratan con 25 ppm (1 ml de formalina por cada 10 galones de H2O) de formalina en días alternos hasta que se elimine la infección. Por lo general, el agua se cambia los días entre tratamientos. Los peces de estanque son tratados con 15 a 25 ppm. Se debe tener cuidado cuando la formalina se usa en estanques ya que mata a las algas en el estanque, por lo tanto, no habrá una buena fuente de oxígeno Prevención: Esto se logra a través de buenas prácticas de cría que incluyen la cuarentena y el tratamiento profiláctico de nuevos peces antes de la introducción en un estanque o sistema de acuario. Debido a que la periodicidad del ciclo de vida de I. multifiliis está inversamente relacionada con la temperatura, los peces deben aislarse en agua a temperatura elevada para reducir el tiempo necesario para mantenerlos bajo observación.
- 13. 13 • ARGULOSIS Introducción: La argulosis es una enfermedad conocida también como “enfermedad de piojo del agua” y es causada por un crustáceo ectoparásito llamado Argulus spp y la especie más reconocida es Argulus japonicum. Los argulidos han sido reconocidos como plagas de la trucha cultivada en Europa y la carpa en China desde el siglo XVII. Causan mortalidad de peces en acuarios, estanques de peces, lagos y estuarios. Aunque son menos comunes en el mar, los argulidos ocasionalmente causan problemas en salmónidos enjaulados. Distribución geográfica: Argulus japonicum tiene una distribución mundial. Fue introducido con peces de acuario de Oriente y ahora es común donde quiera que haya peces de colores. En América del Norte infesta principalmente peces de colores, pero se ha encontrado en carpas y pez gato. Su distribución se superpone con la de A. foliaceus, pero generalmente se encuentra en aguas más cálidas. Morfología: Argulus spp mide de 3-15 mm de longitud y, como todos los branchiuridos, presenta un cuerpo dorsoventralmente aplastado que comprende: (I) una cabeza con cinco apéndices cefálicos; (II) un tórax con cuatro toracópodos; y (III) abdomen corto no segmentado. Anterolateralmente en el caparazón hay un par de grandes ojos compuestos, y ligeramente posterior a ellos, un pequeño ojo medio. El caparazón se extiende hacia atrás como un gran escudo lobulado, cubriendo las piernas a cada lado del cuerpo. La característica más obvia de los argulidos es la primer maxila tipo ventosa. Estas son estructuras móviles. El parásito puede separarlos del pez alternativamente y así 'caminar' sobre la superficie del pez. A cada lado del caparazón hay dos estigmas respiratorios, donde la cutícula es delgada, permeable, desprovista de espinas y adyacente a un seno sanguíneo. Presentan una probóscide que se forman a partir de las mandíbulas, en la entrada de la boca hay dos proyecciones cónicas, las "espinas labiales" o "sifones", que tienen un poro en la punta, que probablemente secreta enzimas que ayudan a la digestión. Las hembras crecen más grandes que los machos. Por lo general, pueden reconocerse antes de que maduren por los receptáculos seminales prominentes
- 14. 14 (espermateca) en el abdomen. Los huevos de A. foliaceus eclosionan en 17 días a 23 ° C y 30 días a 20 ° C. Todo el ciclo de vida toma 55 días a 20 ° C. Los huevos de A. japonicus eclosionan después de 10 días a 35 ° C y después de 61 días a 15 ° C. La eclosión es asíncrona y no está relacionada con la posición del huevo en la masa de huevos. Ciclo biológico: El ciclo de vida es muy simple, cuando Argulus nace del huevo es inmediatamente infectante y, por lo general, se adhiere a la especie huésped sobre la que madurará. Las crías de A. foliaceus, A. japonicus, A. coregoni, A. americanus, Argulus catostomi, Argulus lepidostei y Argulus maculosus son similares a los copépodos, con largas segundas antenas y palpos mandibulares. Después de varios días mudan a la segunda etapa, que se asemeja a un adulto. Después de otras cinco a seis mudas (ocho en A. coregoni y A. foliaceus) a intervalos de 2 a 6 días, maduran en aproximadamente 4 semanas, dependiendo de la temperatura, para que los adultos copulen y la hembra deposite huevos. Huéspedes: La mayoría de los branchiuridos son parásitos de agua dulce, mientras que algunos se encuentran en ambientes marinos. Las tres especies más conocidas son A. foliaceus, Argulus japonicus y Argulus coregoni, todas parasitan peces de agua dulce. Signos clínicos: Los peces infestados están letárgicos, permanecen en las esquinas de los tanques, dejan de alimentarse y pierden peso. La carpa con A. foliaceus inicialmente tratará de eliminar el parásito frotando contra la pared. En las infecciones crónicas intensas, la piel se vuelve opaca y las aletas caídas y el pez desganado. La trucha que transporta hasta 1.500 piojos tendrá daño en la aleta y pérdida severa de la escala, especialmente en la superficie dorsal. Patogenia: Los piojos de los peces se alimentan insertando un estilete en el huésped y succionando los fluidos corporales con la boca tipo probóscide. Los peces pueden mostrar una natación errática violenta u otras anormalidades de comportamiento debido a la irritación causada por el estilete. Los peces son dañados por la perforación repetida de la piel por el estilete, que inyecta enzimas tóxicas, causando irritación. Además, los ganchos y las espinas se encuentran en los apéndices, lo que puede causar daños mecánicos. Esta irritación puede causar hemorragia focal o hiperpigmentación. Los peces pueden generalmente se encuentran anémicos. Argulus también puede transmitir patógenos bacterianos o virales de manera mecánica. Uno o dos parásitos generalmente no causan signos clínicos en los peces grandes, pero los piojos tienen una alta tasa de reproducción, lo que a menudo resulta en una rápida infestación masiva.
- 15. 15 Diagnóstico de la infección: El diagnóstico se realiza fácilmente mediante la identificación morfológica del parásito. Los branchiuridos se diferencian de los copépodos caligoides por tener ventosas y ojos grandes y compuestos. Los piojos de los peces con frecuencia se mueven sobre un huésped y se pueden ver nadando cuando están en un acuario. A menudo permanecen unidos cuando el hospedero se retira del agua. Tratamiento y control: Se han sugerido muchos métodos para controlar y tratar infecciones con Argulus. Los métodos para interceptar la ovoposición son probablemente los más efectivos desde el punto de vista ambiental, y ya se han logrado algunos avances, por ejemplo, colocando tablas de varios colores y en varias profundidades para atraer a Argulus a depositar sus huevos. La eliminación frecuente de los tableros eliminó casi por completo los parásitos de los estanques, deteniendo así la infección. La presencia de solo un puñado de hembras grávidas en un gran estanque de peces es suficiente para reiniciar la infección del parásito en el estanque. Los pesticidas organoclorados y organofosforados han demostrado ser efectivos contra las infecciones por Argulus, y existe una abundante literatura sobre este tema. Como ejemplo Tavares-Dias et al. (1999) utilizaron el organofosfato clorado Triclorphon a 0.4 mg / 500 L de agua, mientras que sustancias químicas similares se han usado a concentraciones de 2.5 mg / 1 L y 0.25 ppm en otros casos. Prevención: Para evitar la introducción de argulidos en los criaderos, el agua puede filtrarse o tomarse de una fuente libre de peces. Los peces nuevos deben ser puestos en cuarentena y, si es necesario, tratados, ya sea utilizando productos químicos o mediante la eliminación física del Argulus con pinzas.
- 16. 16 • LERNEOSIS Introducción: Los lernaeidos o gusanos ancla son plagas comunes en la acuicultura de agua dulce de ciprínidos y, en menor medida, de salmónidos y otros peces, causados por el copépodo Lernaea spp. Las epizootias en peces cultivados a menudo se asocian con una alta mortalidad. Los parásitos también causan problemas en lagos artificiales y en acuarios comerciales. Son particularmente patógenos para peces pequeños debido a su tamaño relativamente grande. Distribución geográfica: Lernaea cyprinacea tiene una distribución mundial. La distribución del parásito está dada en parte por la temperatura del agua. Su temperatura óptima es de 26-28 ° C. Por lo tanto, en climas templados, el parásito es más común a fines del verano. Es más frecuente en aguas tranquilas o de flujo lento que en corrientes de flujo rápido y menos común durante las inundaciones que en las sequías. Morfología y ciclo biológico: La hembra adulta Lernaea cyprinacea tiene un pequeño cefalotórax semiesférico, que contiene la boca. Detrás de él se encuentra un sujetador bien desarrollado, que normalmente consta de dos procesos dorsal bifurcados y dos procesos ventrales simples. El cuello y el tronco alargados llevan los cuatro pares de piernas de la hembra premetamorfoseada. El abdomen es corto. El soporte y parte del tronco se entierran en el hospedero mientras que la mayor parte del tronco y el abdomen se proyectan hacia el agua. L. cyprinacea tiene tres etapas de naupliar de vida libre y cinco etapas de copépodos. Las etapas naupliar son no alimentarias y mudan a los copépodos infecciosos en aproximadamente 4 días. Los copépodos suelen estar en las branquias y son relativamente inmóviles, aunque no están permanentemente unidos. Los copépodos finalmente mudan a machos adultos que se mueven libremente o hembras premetamorfoseadas en 7 días o más, dependiendo de la temperatura. Los machos adultos mueren dentro de las 24 h. Las hembras son fecundadas y atacan al mismo huésped o nadan hacia otro huésped, donde mastican y tapan los tejidos del huésped a medida que se metamorfosean en adultos. Dentro de 1 día, antes de que se hayan metamorfoseado por completo, producen su primer lote de huevos. Estos eclosionan 24 a 36 h más tarde y los sacos de huevos se desprenden. Se produce un nuevo par de sacos de huevos dentro de 1 a 3 días. Los sacos de huevos más grandes se producen de 5 a 10 días después de la metamorfosis y los parásitos mueren dentro de los 30 días a 28-32 ° C. El desarrollo se reduce en gran medida a temperaturas más bajas; a 20 ° C, los nauplios tardan 7 días en mudarse a copépodos y cesan por completo el desarrollo por debajo de esta temperatura. Sin embargo, en climas templados fríos, los parásitos probablemente hibernan como hembras metamorfizadas. L. cyprinacea requiere solo un hospedero para completar su ciclo de vida, generalmente un ciprínido, aunque se han encontrado hembras adultas en muchas especies de peces y los copépodos también tienen una especificidad de hospedero relativamente baja.
- 17. 17 Signos clínicos: Los parásitos de la hembra adulta se pueden observar macroscópicamente y están rodeados por un área hemorrágica en la piel. El parásito se extiende desde la herida y no es inusual observar dos bolsas de huevos unidas al extremo posterior del parásito. Un área de hasta 1 cm de diámetro que rodea al parásito a menudo se encuentra roja e inflamada. Las lesiones sin parásitos también son comunes. Las infecciones de larvas (copépodos) ocurren en las branquias y la piel. Las larvas son pequeñas (0,6 mm) y pueden observarse solo con un microscopio y, por lo tanto, pueden pasar desapercibidas. Los peces infectados pueden mostrar dificultad respiratoria.
- 18. 18 Patogenia: La destrucción mecánica de la epidermis y la dermis causada por los copépodos estimula la inflamación. Cuando los parásitos son abundantes en las branquias, precipita a la dificultad respiratoria a través del edema, mala transferencia de gases y disminución de la circulación sanguínea en las lamelas. La mortalidad del huésped causada por hembras adultas generalmente es el resultado de la destrucción física de los tejidos. Los parásitos también inducen necrosis por presión y pueden secretar una enzima histolítica y/o digestiva. Los peces pequeños (4-6 cm) y los renacuajos sufren más que los peces grandes porque la cabeza del parásito a menudo entra en la cavidad del cuerpo y penetra en el hígado, o penetra el cerebro, la médula espinal u otro órgano vital. Diagnóstico: Las hembras adultas pueden verse macroscópicamente, los copépodos requieren el uso de un microscopio. Cuando se raspa la piel en busca de estos parásitos, la cabeza del parásito puede permanecer incrustada en el pez, dejando solo el delgado cuerpo vestigial. La histopatología también se puede usar para identificar formas adheridas de la hembra en la piel. Tratamiento y control: La eliminación del parásito generalmente requiere tratamiento durante varias semanas para romper el ciclo de vida en la etapa larval, porque las hembras incrustadas son difíciles de matar. Los insecticidas organofosforados, particularmente el triclorfón, se emplean comúnmente. Como los copépodos tardan entre 8 y 9 días en desarrollarse (a 27 ° C), el tratamiento se lleva a cabo cada 7 días para prevenir la reinfección hasta que todas las hembras adultas hayan muerto (en 30 días a 27 ° C). El clorito sódico (20 - 40 mg / L de inmersión prolongada) erradica a L. cyprinacea en un sistema cerrado, pero se deben realizar cambios frecuentes de agua durante las primeras 2 semanas para permitir el establecimiento de bacterias nitrificantes resistentes a clorito.
- 19. 19 • DIPLOSTOMOSIS Introducción: Es una enfermedad causada por un trematodo del género Diplostomum spp, esta enfermedad también es llamada “la enfermedad del punto negro” cuando se asocia con Clinostomum spp. Los trematodos de este género son parásitos ubicuos de peces de agua dulce; infectan los ojos de más de 100 especies de peces en todo el mundo. La mayoría de las investigaciones se han realizado sobre una especie de este género, Diplostomum spathaceum., principalmente porque la infección produce notables efectos nocivos en los peces con una importancia económica significativa. Sin embargo, la taxonomía de los parásitos Diplostomum es muy compleja y todavía no ha quedado clara. Morfología y ciclo biológico: El ciclo de vida de D. spathaceum es típico de trematodos e incluye tres especies de hospederos. La reproducción sexual tiene lugar en el huésped definitivo, que es un ave que come peces, por ejemplo, una gaviota. Los gusanos hermafroditas adultos se aparean en el intestino y comienzan a producir óvulos 3-4 días después del establecimiento. Un ave generalmente está infectada con varios cientos de gusanos, cada uno de los cuales puede liberar varios cientos de huevos por día. Los huevos se liberan en el medio acuático con heces del huésped, donde eclosionan a larvas de miracidia en 2 semanas en las temperaturas de verano. Los miracidios son efímeros y buscan activamente al primer huésped intermedio, un caracol de agua dulce. Varias especies de caracoles pueden actuar como huéspedes de los parásitos Diplostomum, pero los del género Lymnaea son los más comunes. Dentro del caracol, el parásito se reproduce asexualmente formando esporoquistes, que ocupan el sistema reproductivo del caracol que conllevan a la castración del mismo. Las cercarias se forman dentro de los esporoquistes y se liberan al agua en grandes cantidades. Las
- 20. 20 cercarias están equipadas con una cola bifurcada. Después de entrar en contacto con un pez, las cercarias penetran en el epitelio de las agallas y la piel, dejan caer la cola y entran en el cuerpo del huésped. La migración de la cercaria desde la penetración hasta el establecimiento en el cristalino generalmente se completa dentro de las 24 h, pero puede llevar más tiempo a bajas temperaturas. Después de alcanzar la lente ocular, los diplostomidos se convierten en metacercarias y causan la enfermedad diplostomiasis. Crecen considerablemente en tamaño, primero se alargan antes de tomar su forma ovalada o cilíndrica típica. Este proceso también está controlado por la temperatura del agua; el desarrollo de las metacercarias se completa en unas pocas semanas a 15-20 ° C, pero puede detenerse por completo a bajas temperaturas. El ciclo de vida del parásito se completa cuando un ave come un pez infectado. Signos clínicos: El signo más notable de la infección por D. spathaceum en los peces es la formación de cataratas, cuando el cristalino se vuelve opaco y gris, y la visión del pez se ve afectada. La cuantificación de las cataratas se realiza mejor con un microscopio oftalmológico. Patogenia: La penetración de la cercaria y la migración de los diplostomidos pueden ser perjudiciales, especialmente para los peces jóvenes. Además del daño a la epidermis, los estudios histológicos han demostrado que los diplostomidos penetran en los vasos sanguíneos causando hemorragias internas y respuestas inflamatorias. En una exposición de alto nivel, esto puede dar como resultado una mortalidad aguda de los peces. Sin embargo, los peces más grandes son típicamente más resistentes y rara vez experimentan mortalidad por la infección aguda. En general, parece que la infección crónica por Diplostomum tiene consecuencias metabólicas, que pueden afectar otros rasgos como el crecimiento y la fecundidad. Diagnóstico: Generalmente se hace observando los ojos de los peces, con la opacidad que causa el parásito. Se pueden observar algunos quistes de metacercarias en cortes histopatológicos, pero se habría que diferenciar molecularmente a los trematodos. Tratamiento: Praziquantel es seguro y efectivo contra los cestodos del hombre y los animales. Demostró alta eficacia en un amplio rango de metacercarias: Szekely y Molnar (1991) informaron sobre la eliminación de todas las metacercarias de D. spathaceum de carpa herbívora a las que se les administró una sola dosis del fármaco (300 mg / kg de masa corporal). Prevención: Para adquirir metacercarias, los peces deben estar expuestos al huésped intermedio infectado con cercarias. Erradicar los caracoles con molusquicidas puede ser difícil porque los caracoles a menudo son resistentes al tratamiento. Los caracoles en estanques pueden tratarse con sulfato de cobre o cal. Estos tratamientos no proporcionan la erradicación completa del caracol. Por lo tanto, los estanques deben tratarse varias veces.
- 21. 21 • ANISAKIOSIS Introducción: Los miembros del género de nematodos Anisakis (Orden Ascaridida, Familia Anisakidae), comúnmente conocido como arenque o gusano de ballena, se encuentran en su tercera etapa de larva en numerosas especies de peces teleósteos marinos de todo el mundo, excepto aguas estrictamente antárticas. Varias de las especies huéspedes de peces comúnmente infectadas se encuentran entre los recursos pesqueros más valiosos. Históricamente, solo muy pocas especies han sido reconocidas dentro del género Anisakis, como Anisakis simplex que es la especie más reconocida y, por consiguiente, el más estudiado. Sin embargo, con base en técnicas bioquímicas y moleculares, ahora hay nueve especies nominales de Anisakis dentro de dos clados filogenéticos principales. Distribución geográfica: Los anisákidos tienen una distribución mundial. Morfología: Los anisákidos comparten los rasgos comunes de todos los nematodos; cuerpo vermiforme, sección redondeada y falta de segmentación. La cavidad corporal es estrecha. La boca se encuentra en el lado anterior, rodeada de proyecciones que se utilizan para sentir y alimentarse, con el ano ligeramente fuera del lado posterior. La epidermis segrega una cutícula en capas que protege al cuerpo de los jugos digestivos. Ciclo biológico: Las especies de Anisakis tienen ciclos de vida indirectos y complejos que involucran varias especies de ballenas como hospedadores definitivos, mientras que los crustáceos planctónicos o pelágicos actúan como primeros huéspedes intermedios o de transporte, y los peces y calamares como segundos huéspedes intermediarios o de transporte. Los gusanos adultos viven en el estómago de varios cetáceos como delfines y marsopas o ballenas barbadas. Después de las dos últimas mudas, la maduración y la cópula, las hembras ponen huevos que con las heces del huésped definitivo se expulsan al mar. Allí embrionan produciendo pequeñas larvas 3, que son ingeridas por crustáceos como copépodos o krill en los que crecen dentro del hemocoel. El pescado o el calamar se infectan al comer crustáceos que contienen larvas de la tercera etapa que
- 22. 22 atraviesan la pared del tracto digestivo hacia las vísceras y la cavidad corporal, seguidas por la encapsulación inducida por el huésped. Cuando un pez infectado es devorado por otro pez, las larvas encapsuladas se vuelven libres, repitiendo así el ciclo del hospedador larval. Algunos peces piscívoros grandes y viejos, a veces albergan cientos o miles de larvas encapsuladas. Los huéspedes definitivos se infectan al comer pescado o calamares que contienen larvas. Sin embargo, debido a su pequeño tamaño, la mayoría de las larvas de Anisakis en el pescado pueden permanecer sin detectar durante el procesamiento industrial y, por lo tanto, aún están presentes cuando el producto final llega al mercado. Por lo que esta enfermedad es de gran importancia para los seres humanos, ya que también pueden infectarse. Signos clínicos: A primera vista, cualquier pez que está más o menos fuertemente infectado con larvas de Anisakis sp generalmente parece saludable. La intensidad o cualquier signo macroscópico de la infección se hacen obvios en el examen visual de los órganos viscerales, mesenterio y revestimientos peritoneales. Dependiendo de varios factores, tales como las especies hospedadoras del pez, el tamaño del hospedador y la intensidad de la infección, las larvas pueden aparecer dispersas por separado o en grupos con a veces cientos de gusanos, en los órganos y mesenterio de la cavidad visceral. Patogenia: Como con muchas otras infecciones parasitarias, la capacidad y el grado en que las larvas de Anisakis sp pueden afectar patológicamente al pez huésped parece depender en gran medida de la intensidad de la infección y del sitio de infección (por ejemplo, muchas larvas en órganos vitales como el hígado tienen más probabilidades de inducir más daño tisular que los grupos de gusanos en el mesenterio). Por lo tanto, las infecciones graves de Anisakis sp. Se ha informado que las larvas causan daño severo al hígado en varias especies de peces. Diagnóstico: Por lo general es a la necropsia, y se identifica morfológicamente al parásito. Se puede observar en cortes histopatológicos, pero generalmente son innecesarios. Tratamiento: Las larvas de Anisakis sp. no tienen importancia como parásitos causantes de enfermedades en peces cultivados. En conclusión, las larvas 3 de Anisakis spp deben considerarse como parásitos con una patogenicidad y virulencia generalmente bajas en los peces. En general, los efectos de las infecciones fuertes de las larvas de Anisakis sp en los peces parecen estar influenciados
- 23. 23 por factores que están vinculados con el individuo o especie real del huésped, más que con el parásito en sí. • CONTRACECOSIS. Agente: Contracaecum sp., Contracaecum multipapillatum. Taxonomía: Orden: Ascaridida. Familia: Anisakiidae. Subfamilia: Anisakiinae. Distribución: Mundial Morfología: Adultos miden entre 4-16 mm. Cuerpo cilíndrico, alargado, sin segmentación y puntiagudo a los extremos. La cutícula esta marcadapor estriaciones finas transversales. El sistema digestivo es completo, disponiendo de boca, esófago, intestino y ano. La abertura bucal disponede 3 labios, un diente cuticular cónico y ligeramente romo. El esófago tiene dos porciones bien diferenciadas: una anterior muscular llamada proventrículo y otra posterior glandular llamada ventrículo pequeño y esférico, con apéndice esofágico. Elintestino presenta ciego y poro excretor que se abre inmediatamente posterior al diente. HD: Aves piscívoras y mamíferos marinos como son pelicanos, focas y algunos delfines. Los parásitos adultos y el cuarto estadio larvario residen en el tracto digestivo y se alimentan de la ingesta del hospedador. Su tercer estadio larvario se presenta en peces generalmente encapsulado en las vísceras. Todo esto tiene como resultado enflaquecimiento; exoftalmia; pérdida de sangre en la cavidad del cuerpo; ascárides (gusanos redondos) en el corazón y cavidad del cuerpo. Ciclo biológico: las larvas son ingeridas por HI, en especial copépodos. Los peces que se alimentan de ellos y otros invertebrados sirven de HI vertebrados en los cuales se encapsula en el mesenterio. El ciclo se completa cuando el ave se come al pez infectado y la larva se libera en el tubo digestivo. Tratamiento: No hay un tratamiento específico en los peces. Solo se pueden tomar medidas preventivas para evitar el contagio al humano. Control y prevención: Congelación de pez, no comer pez crudo o insuficientemente cocinado y eliminar a las aves que completan dicho ciclo.
- 24. 24 • GNATOSTOMIASIS La gnatostomiasis es causada por miembros del género Gnathostoma que experimentan migración larvaria visceral. Cuatro especies se han encontrado en humanos. Los nematodos gnastostomátidos se caracterizan por un bulbo cefálico y un sistema cefálico- cervical lleno de líquido. La pared del bulbo de la cabeza está forrada con musculatura circular. Tanto el bulbo de la cabeza como la cutícula del cuerpo tienen filas de espinas. Los huéspedes definitivos son cerdos, gatos (y otros felinos), jabalíes y comadrejas. Sirven como fuente de infecciones humanas. El gusano adulto está ubicado en una estructura parecida a un tumor en el estómago o el esófago; la cabeza del gusano está incrustada dentro de la pared. La larva infecciosa de la tercera etapa se somete a una extensa migración tisular si es ingerida por humanos. La infección puede ser fatal. Distribución geográfica: La enfermedad ocurre en el sudeste de Asia, China, Japón, Corea, el subcontinente indio, Medio Oriente y México. Sin embargo, debido a la naturaleza de la infección y la falta de un método seroepidemiológico específico, rara vez se han llevado a cabo estudios epidemiológicos a gran escala. Ciclo biológico: Los especímenes adultos se encuentran en nódulos quísticos en las paredes estomacales de carnívoros salvajes y domésticos. Los huevos se desarrollan a L1que tiene dos células y se después pasa a la segunda etapa de larva en el agua. Estas larvas eclosionan y se desarrollan en la L3 infecciosa solo si son ingeridas por copépodos. Una variedad de anfibios, serpientes y peces pueden servir como huéspedes paraténicos para transportar el gnatóstomo del copépodo al huésped definitivo. En el huésped definitivo, las larvas experimentan una extensa y destructiva migración de tejidos antes de regresar al estómago. Los nódulos quísticos en el estómago que alojan al adulto maduro pueden abrirse en la cavidad peritoneal con un desenlace fatal. En Asia, Gnathostoma spinigerum es una especie que se encuentra más comúnmente en los estómagos de perros y gatos; es responsable de la mayoría de las infecciones larvales que ocurren en los seres humanos. En las personas que adquieren la infección ingiriendo copépodos o pescado crudo, las larvas tienden a vagar sin rumbo sin madurar, a veces durante casi una década.
- 25. 25 Patogenia: La patogénesis de la gnostomiasis probablemente sea causada en parte por las toxinas secretadas por las larvas migratorias. Estos incluyen acetilcolina, enzimas proteolíticas, un compuesto hemolítico y sustancias similares a hialuronidasa. Las lesiones típicas de la infección generalmente muestran áreas de degeneración, necrosis y edema perivascular, con fuertes infiltraciones celulares de polimorfos. También se producen exudados hemorrágicos, leucocitos mononucleares y fibroplasia. Síntomas en humanos: La enfermedad se caracteriza por eosinofilia (5-90%) y la presencia de inflamaciones migratorias de diferentes tamaños, que pueden ubicarse en el tórax, el abdomen, la cabeza, el párpado y otras partes del cuerpo. La afectación de los ojos puede mostrar iritis, equimosis, hemorragias subconjuntivales y celulitis orbitaria. La afectación de los pulmones provocará tos leve y dificultad para respirar. La afectación del sistema nervioso central ocasionará irritación meníngea, dolor de cabeza, convulsiones, hipoestesia, paresia, paraplejía, coma y, a veces, la muerte. Solo ocasionalmente se produce una ligera fiebre. En peces no causa enfermedad, ya que estos son huéspedes paraténicos. Diagnóstico: Aunque las larvas 3 se pueden extirpar quirúrgicamente de las hinchazones superficiales, el serodiagnóstico debe servir como el método clave de diagnóstico. Sin embargo, en ELISA e IFAT, hay reacciones cruzadas significativas entre los antígenos brutos y el antisuero heterólogo de G. spinigerum, G. hispidum y Angiostrongylus cantonensis. Por lo tanto, antes de que los métodos serológicos puedan usarse para el diagnóstico diferencial, primero se deben aislar antígenos altamente específicos de Gnathostoma spp. Tratamiento: Los gusanos se pueden extirpar quirúrgicamente cuando están cerca de la piel. El tiabendazol, en dosis de 2 g diarios durante 20 días, puede ayudar a aliviar algunos síntomas. El albendazol también se ha probado, pero los resultados no fueron satisfactorios. Sin embargo, según Tierney et al. (2001), el albendazol a dosis de 400 u 800 mg diarios durante 21 días puede ser efectivo. La ivermectina (dosis única) también se ha sugerido para ser efectiva
