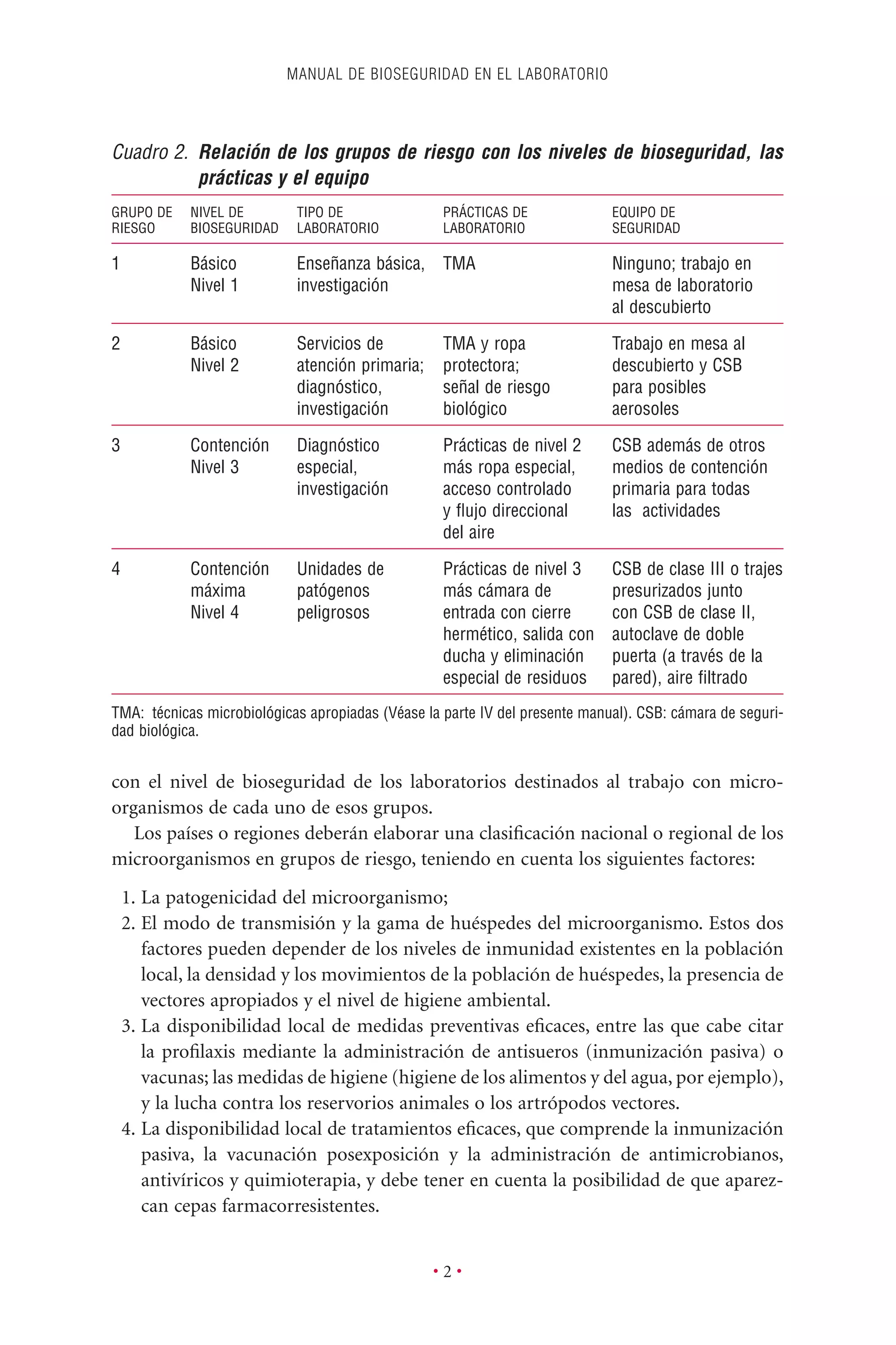
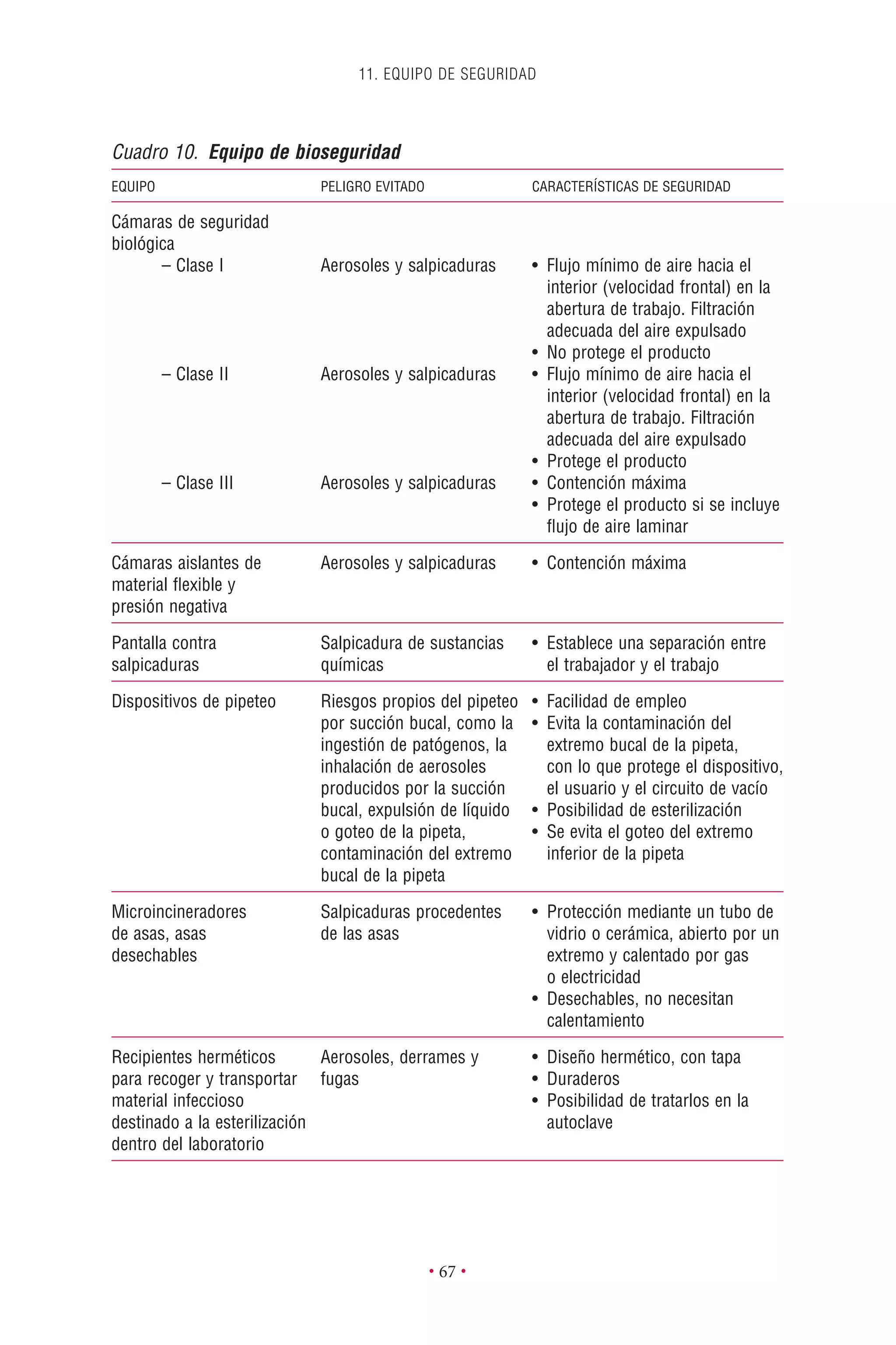
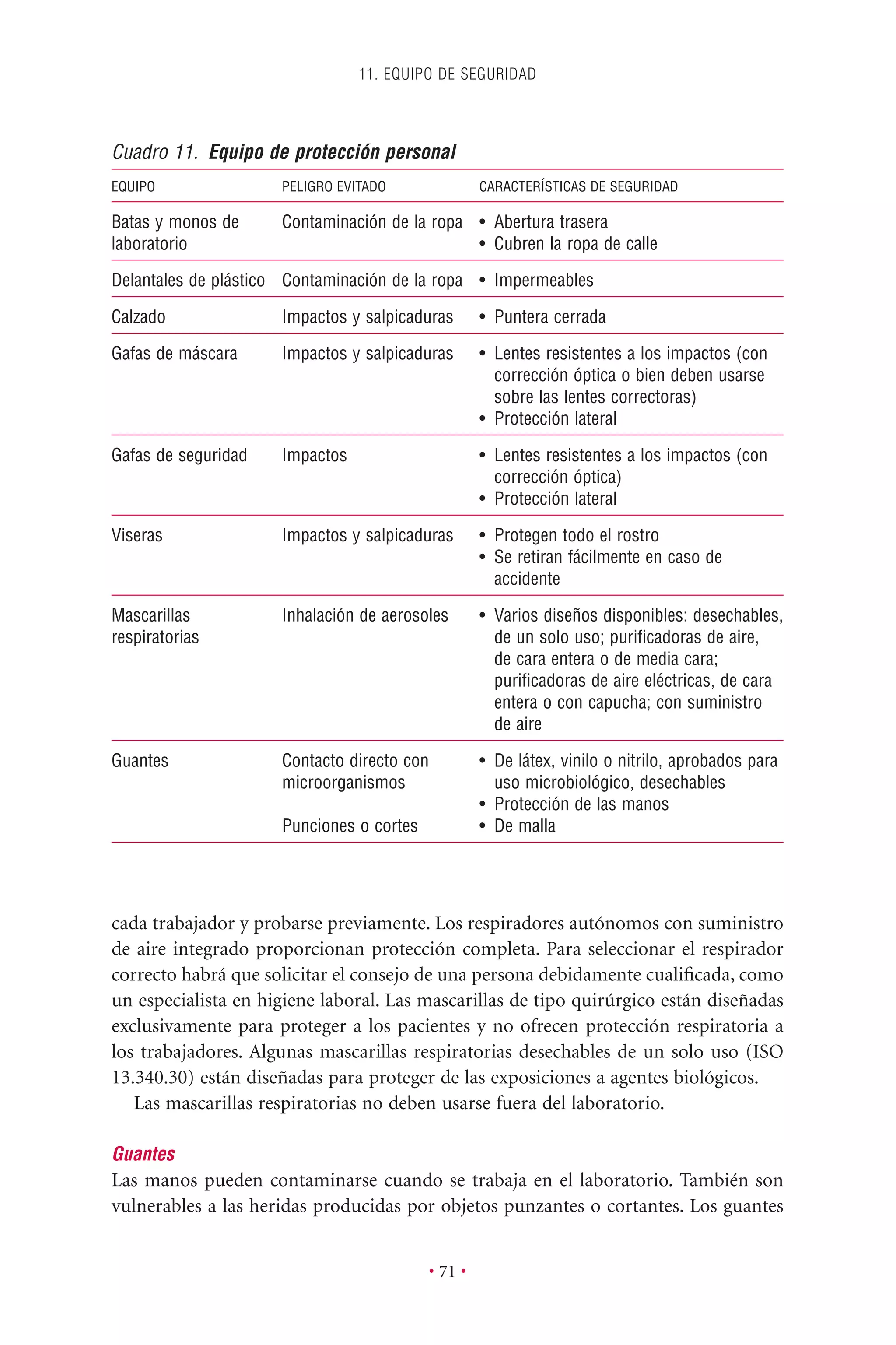
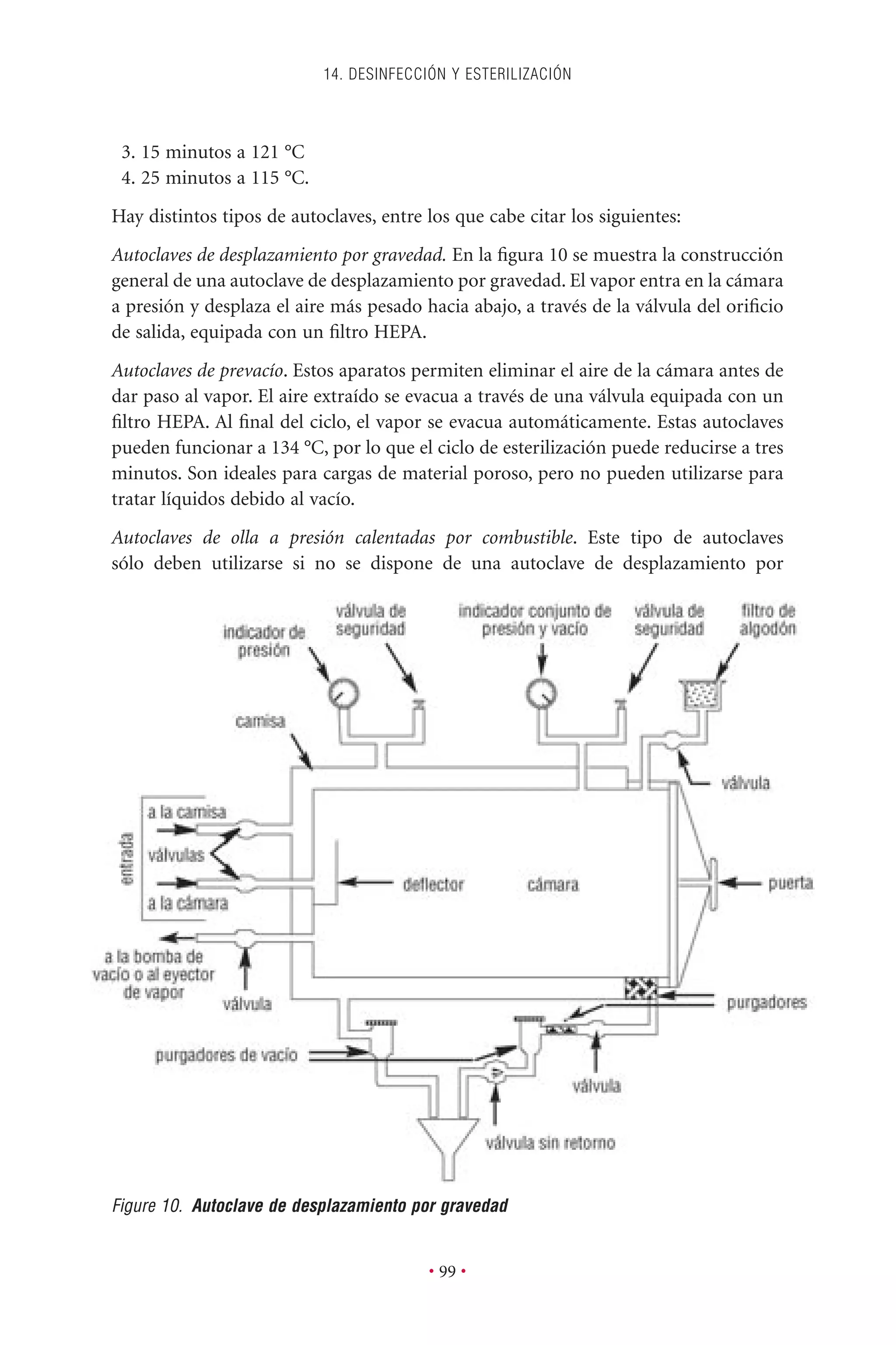
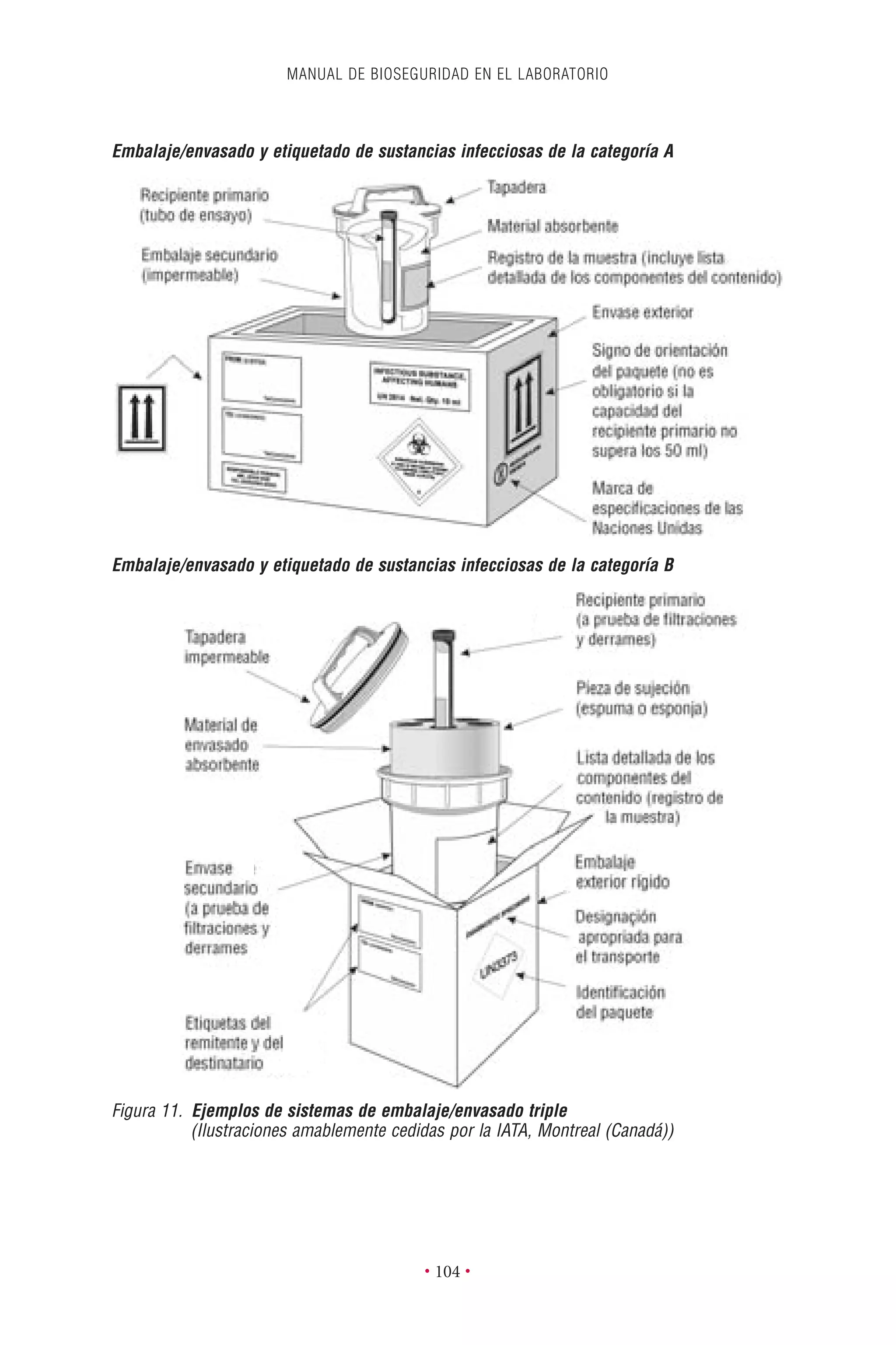
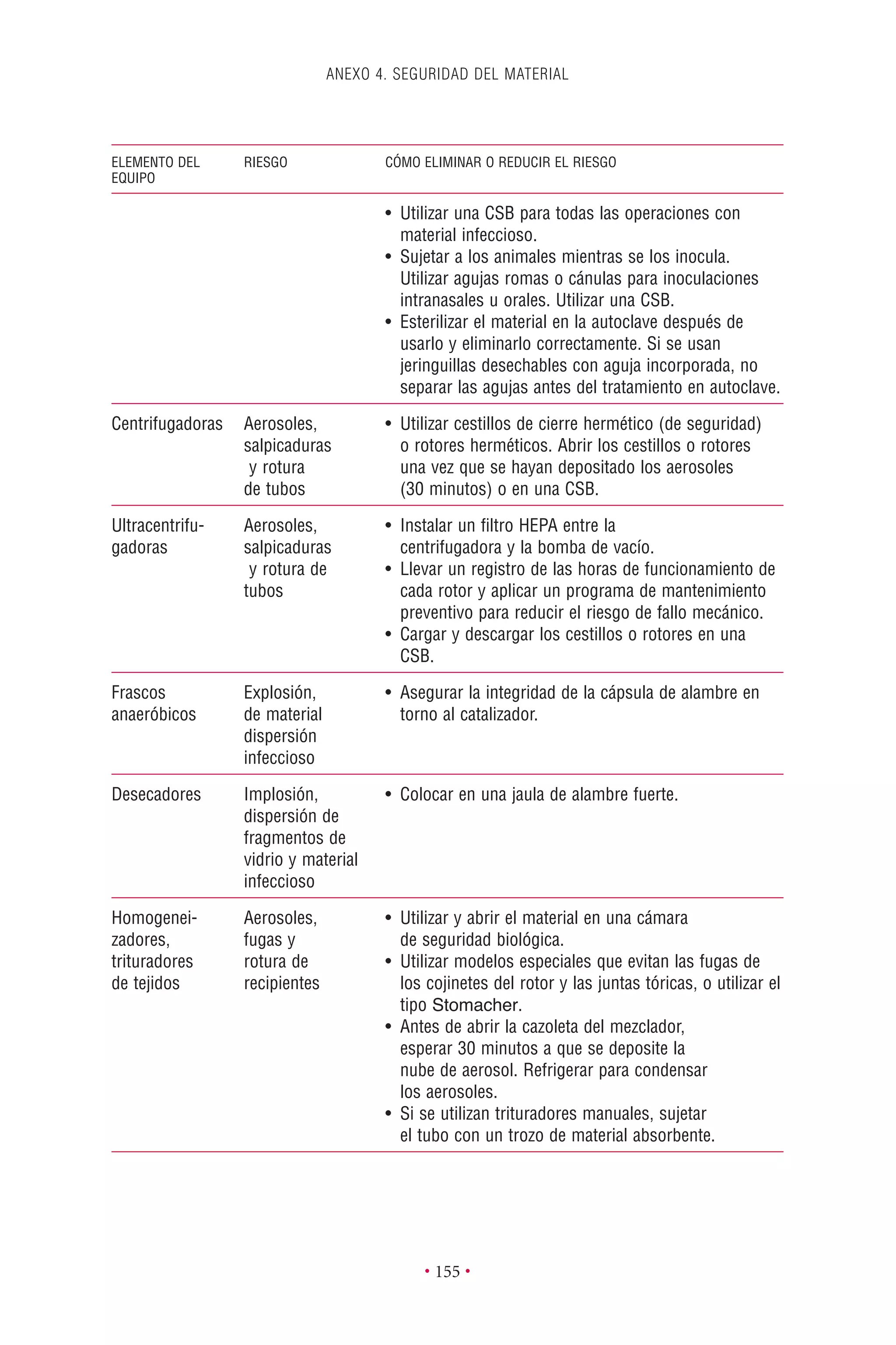
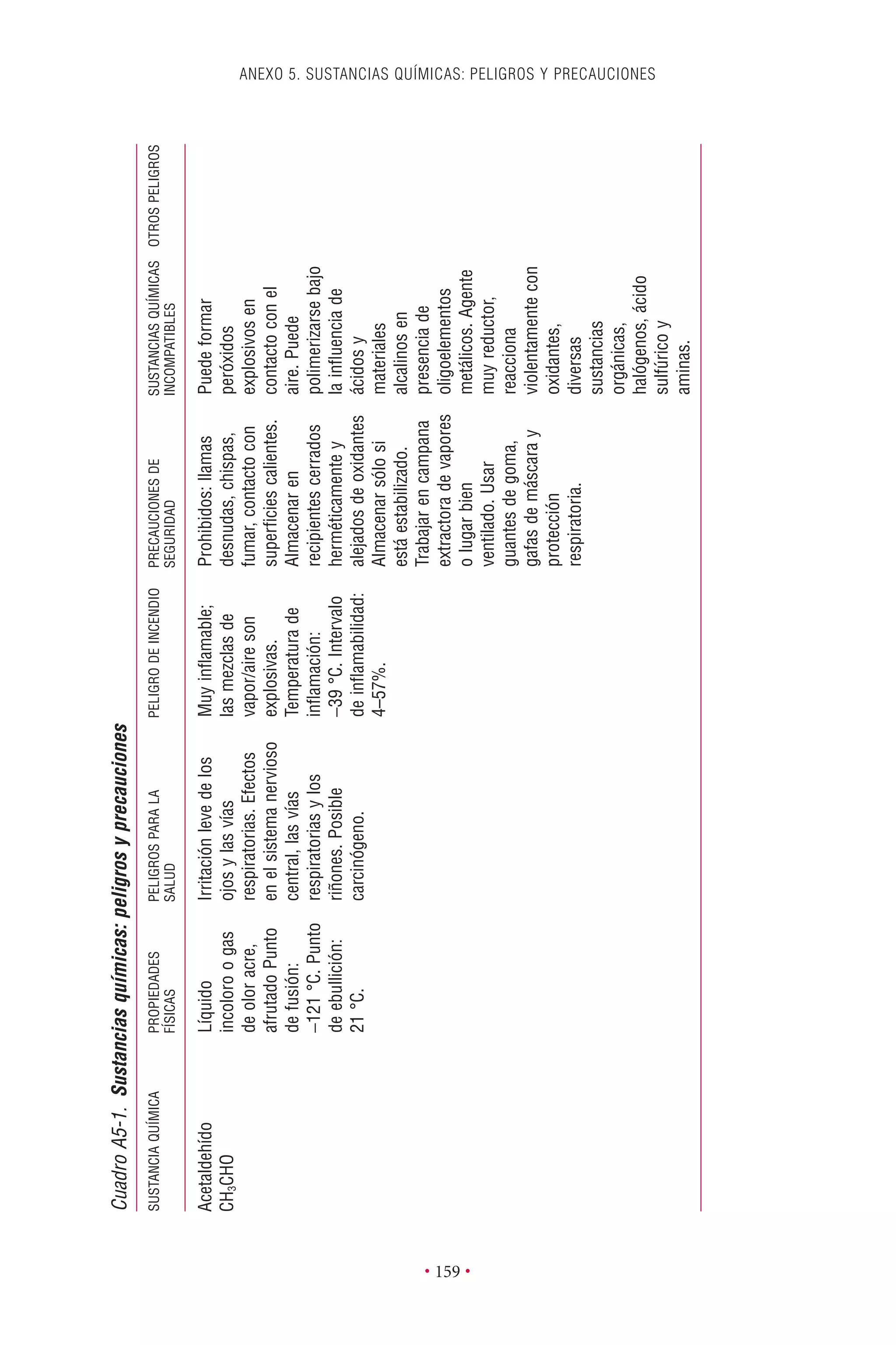
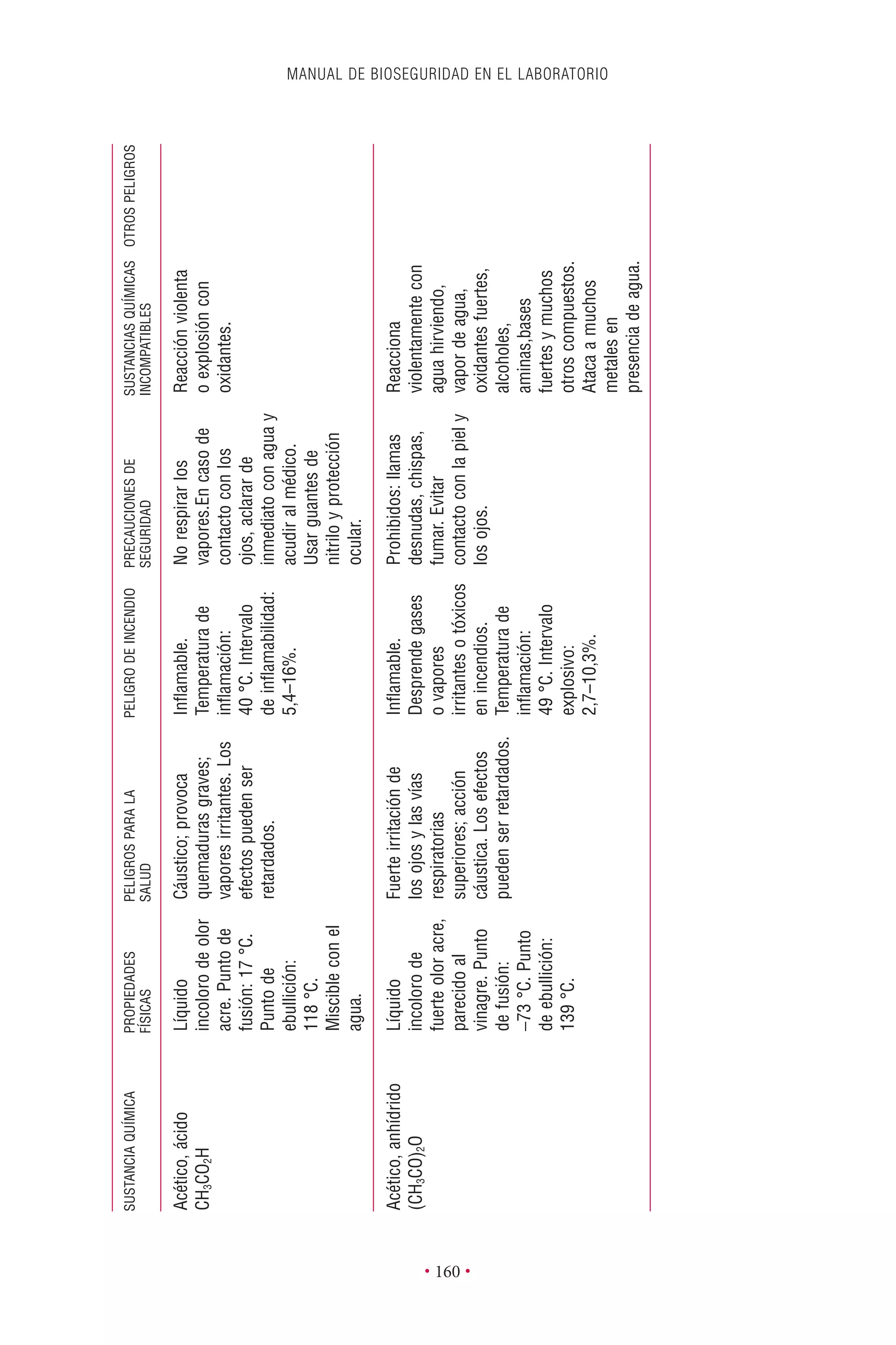
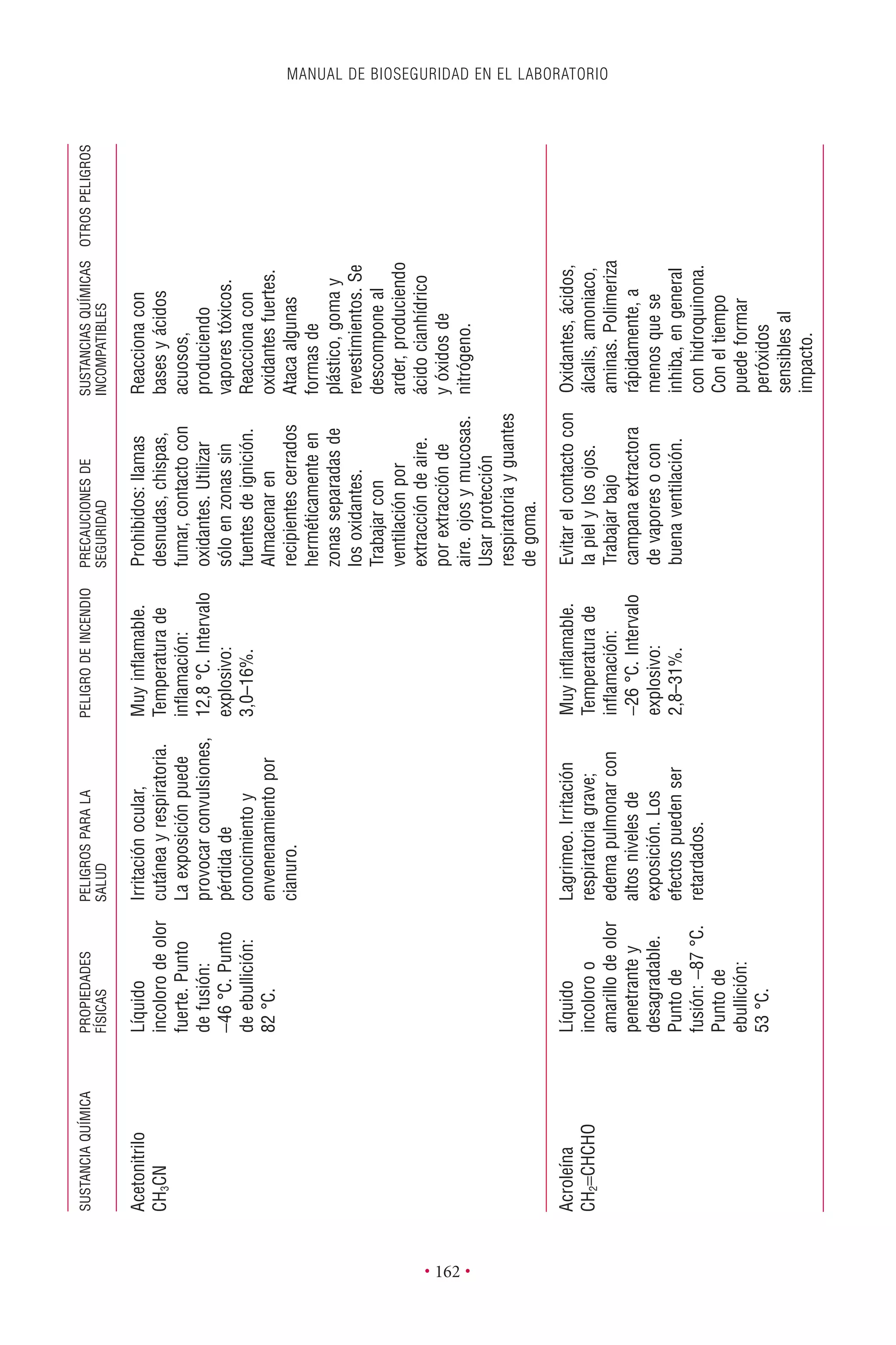
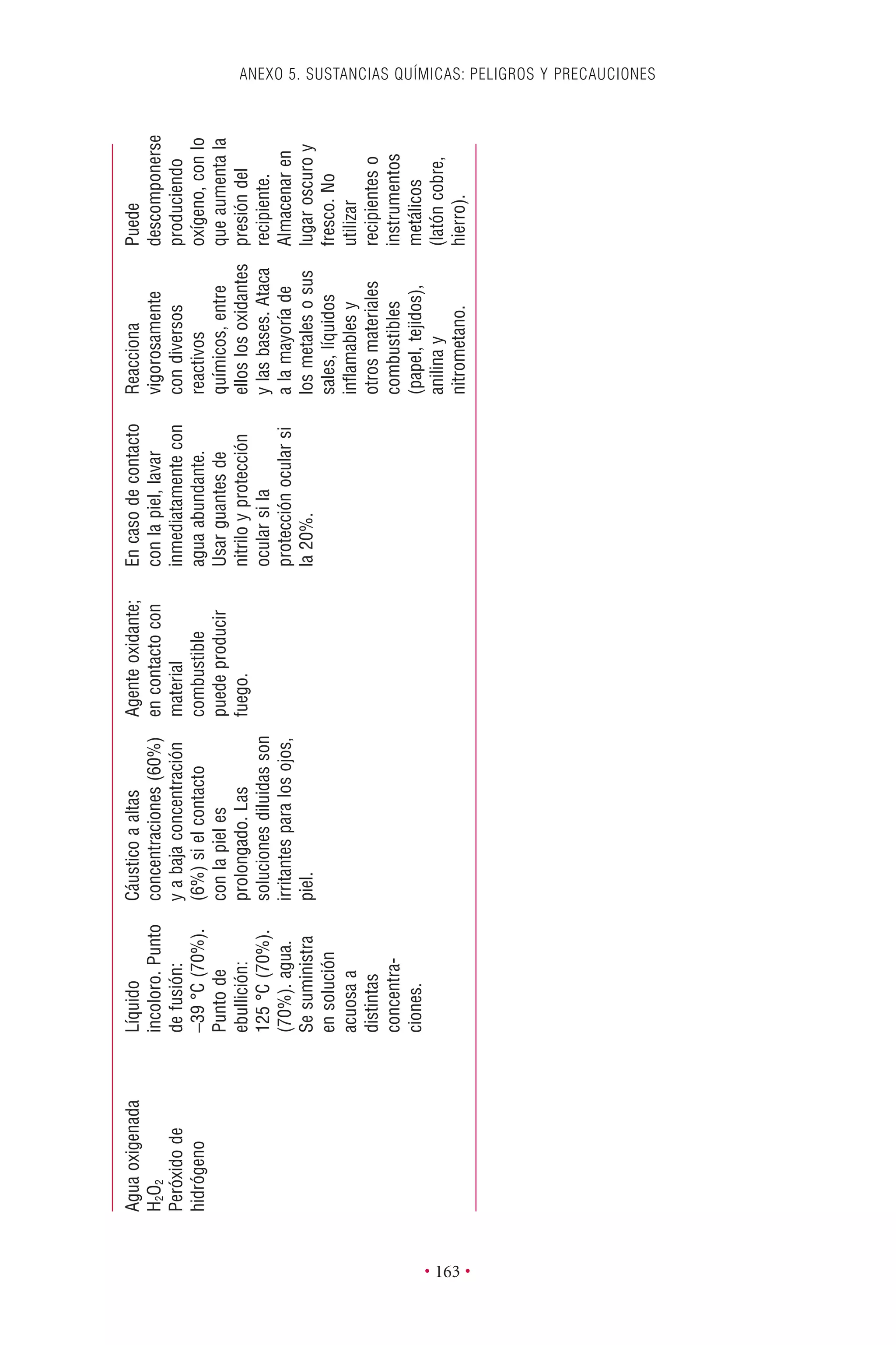
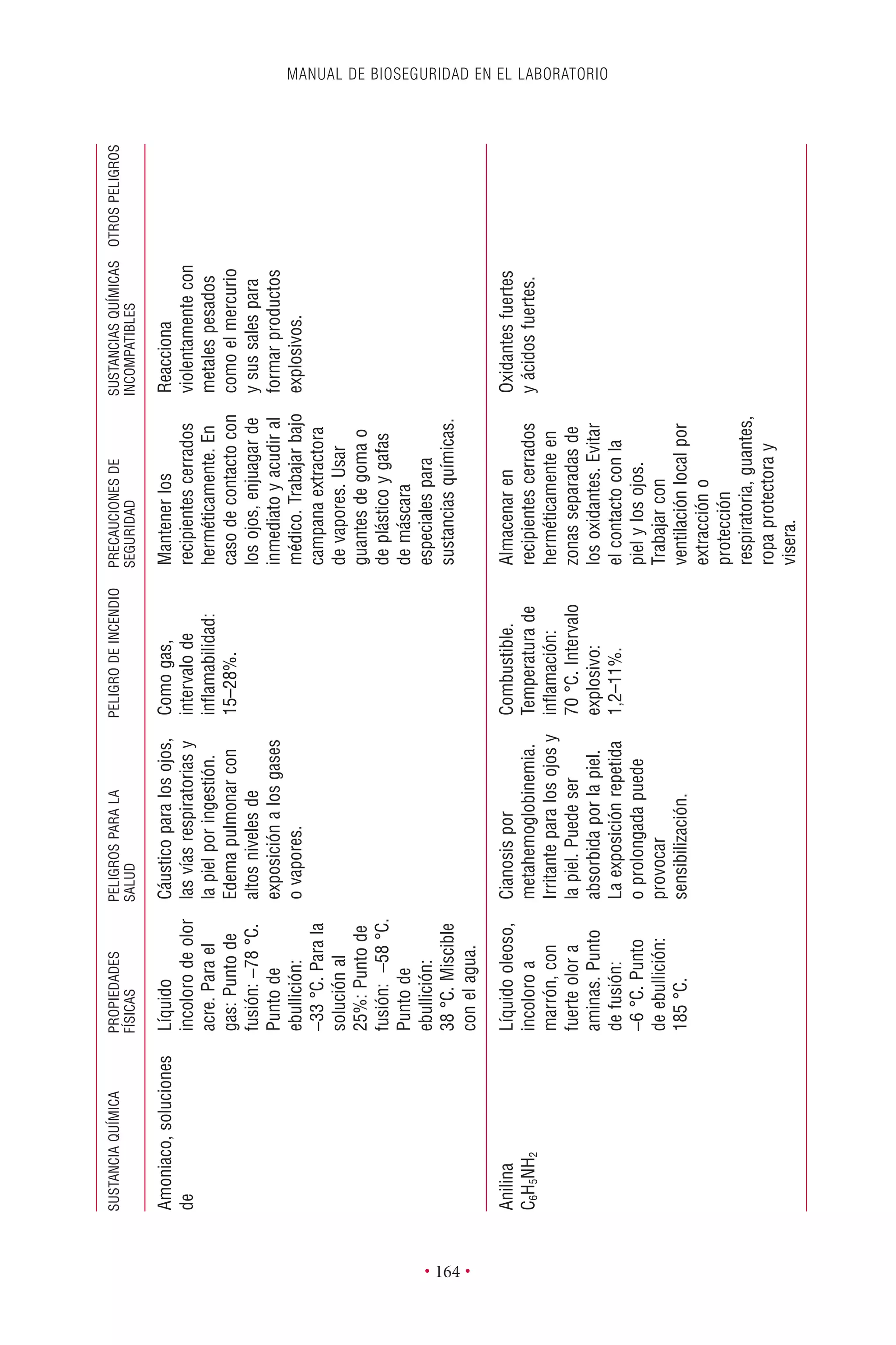
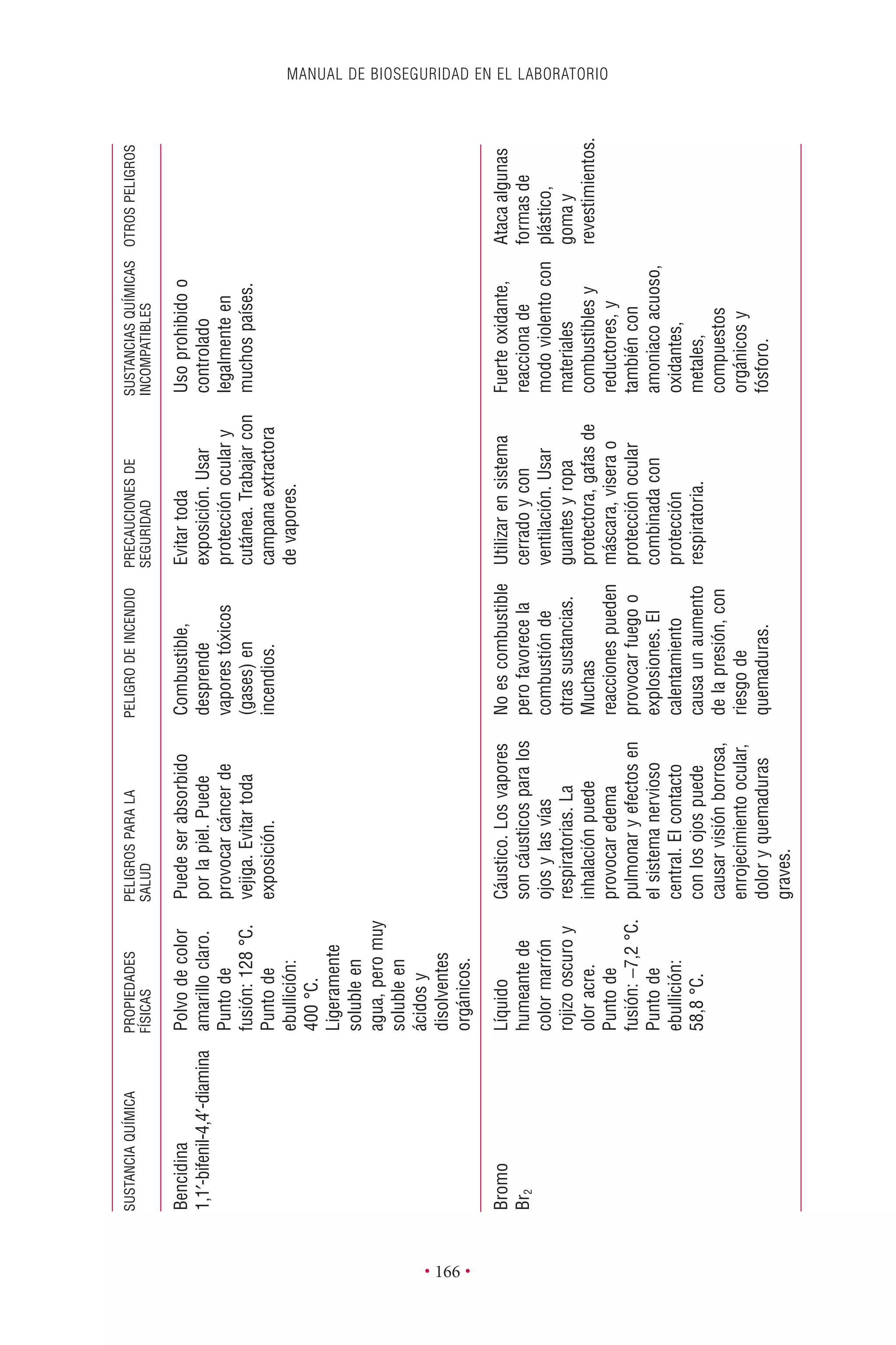
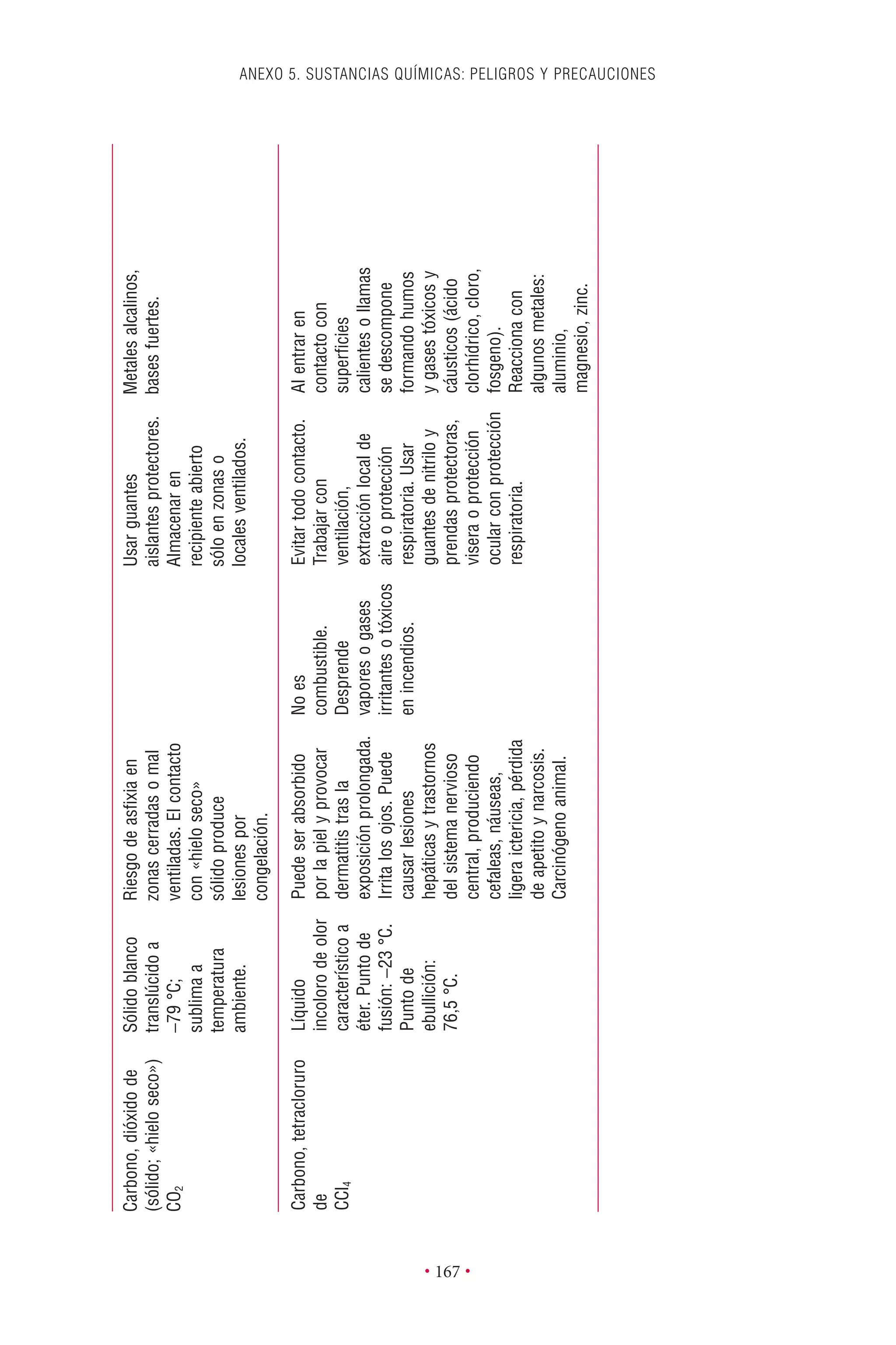
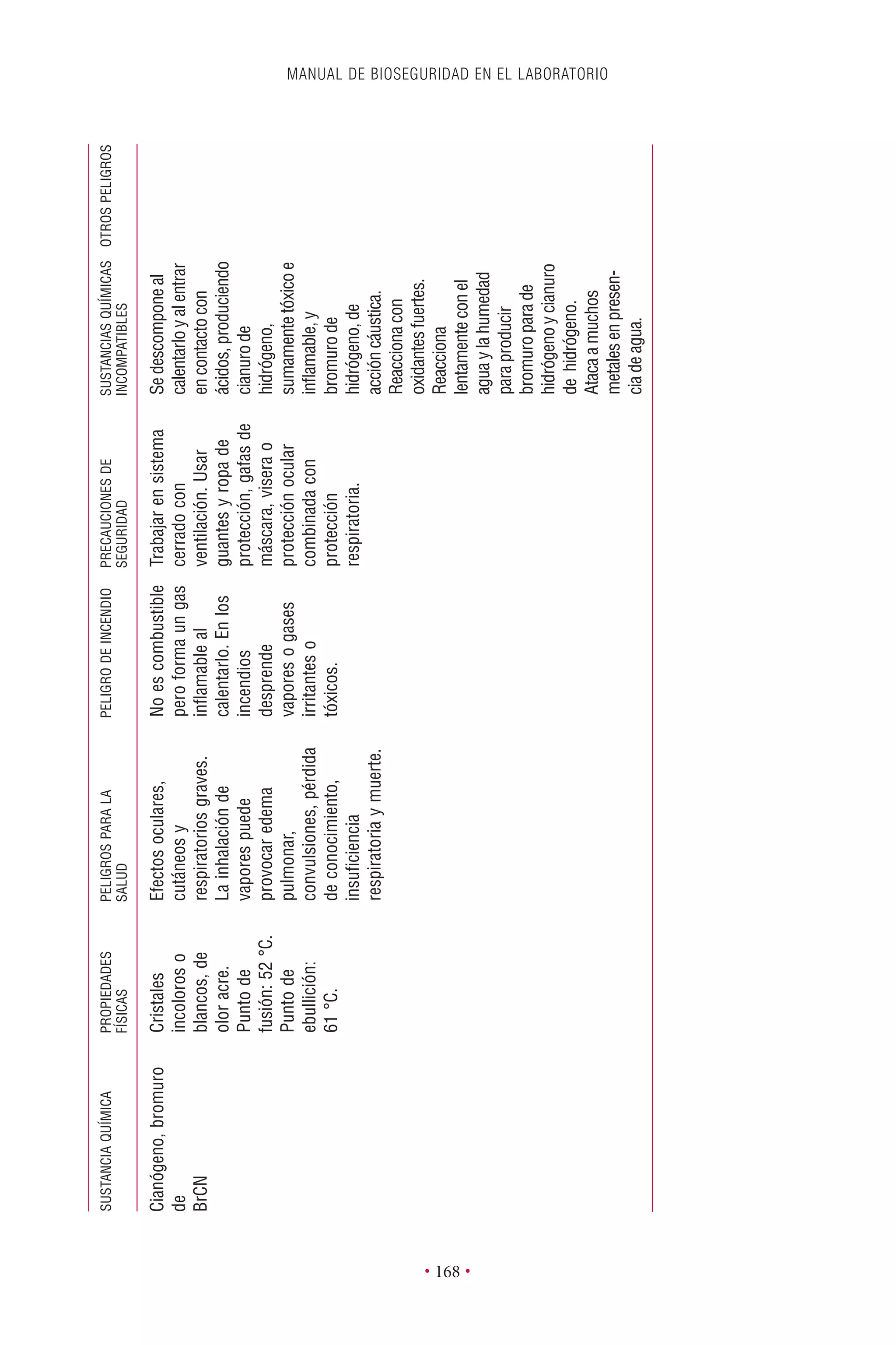
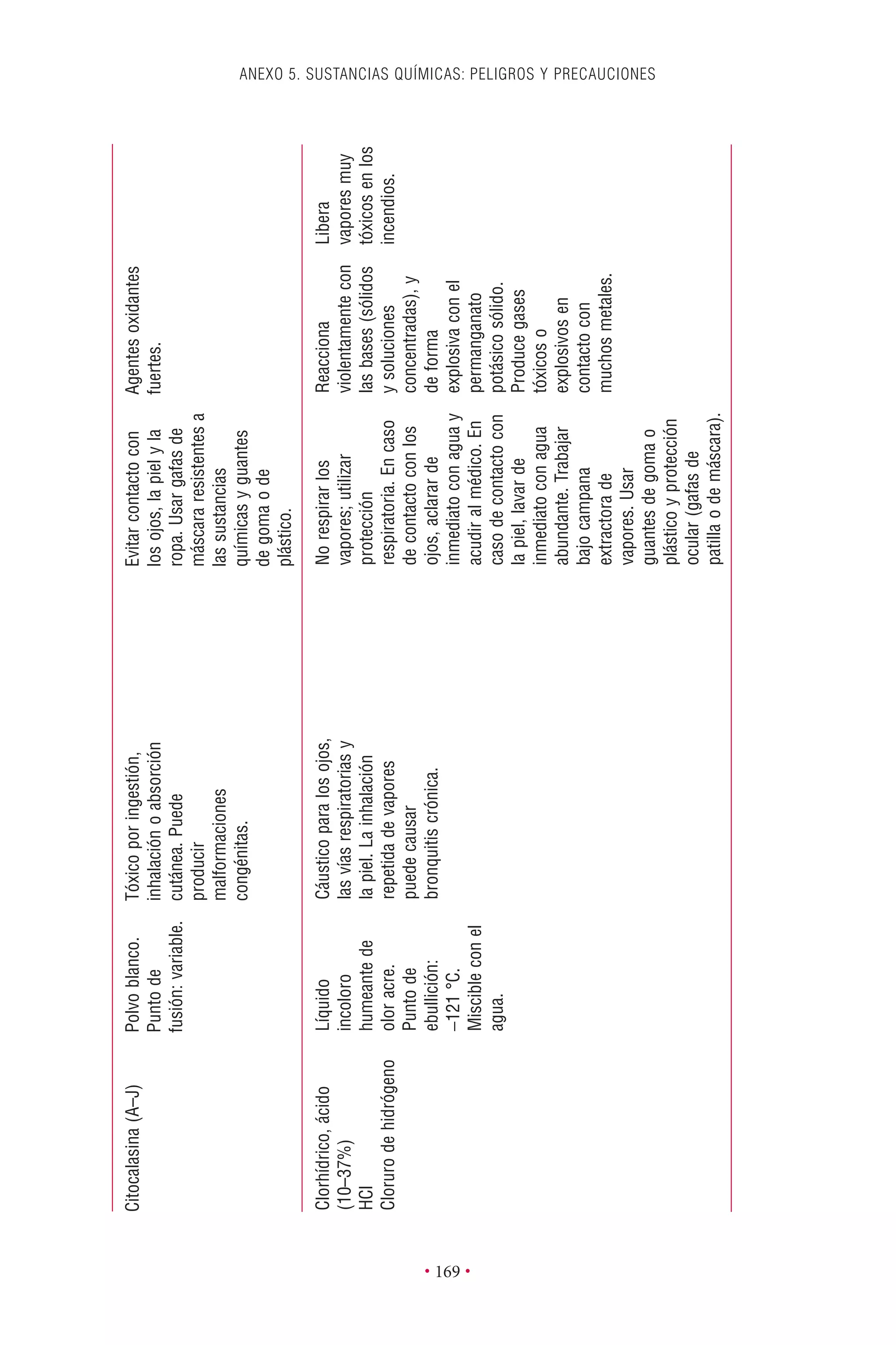
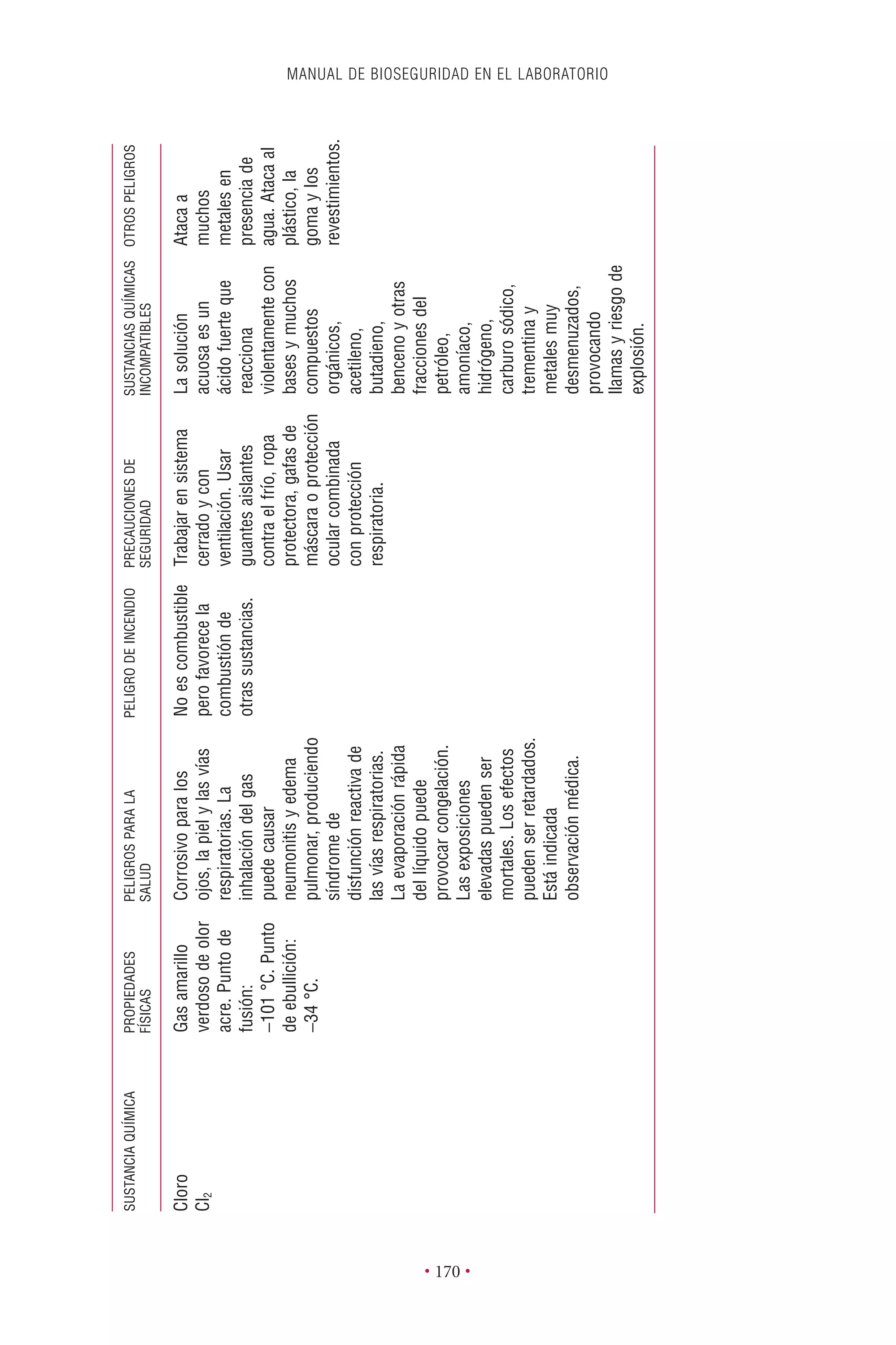
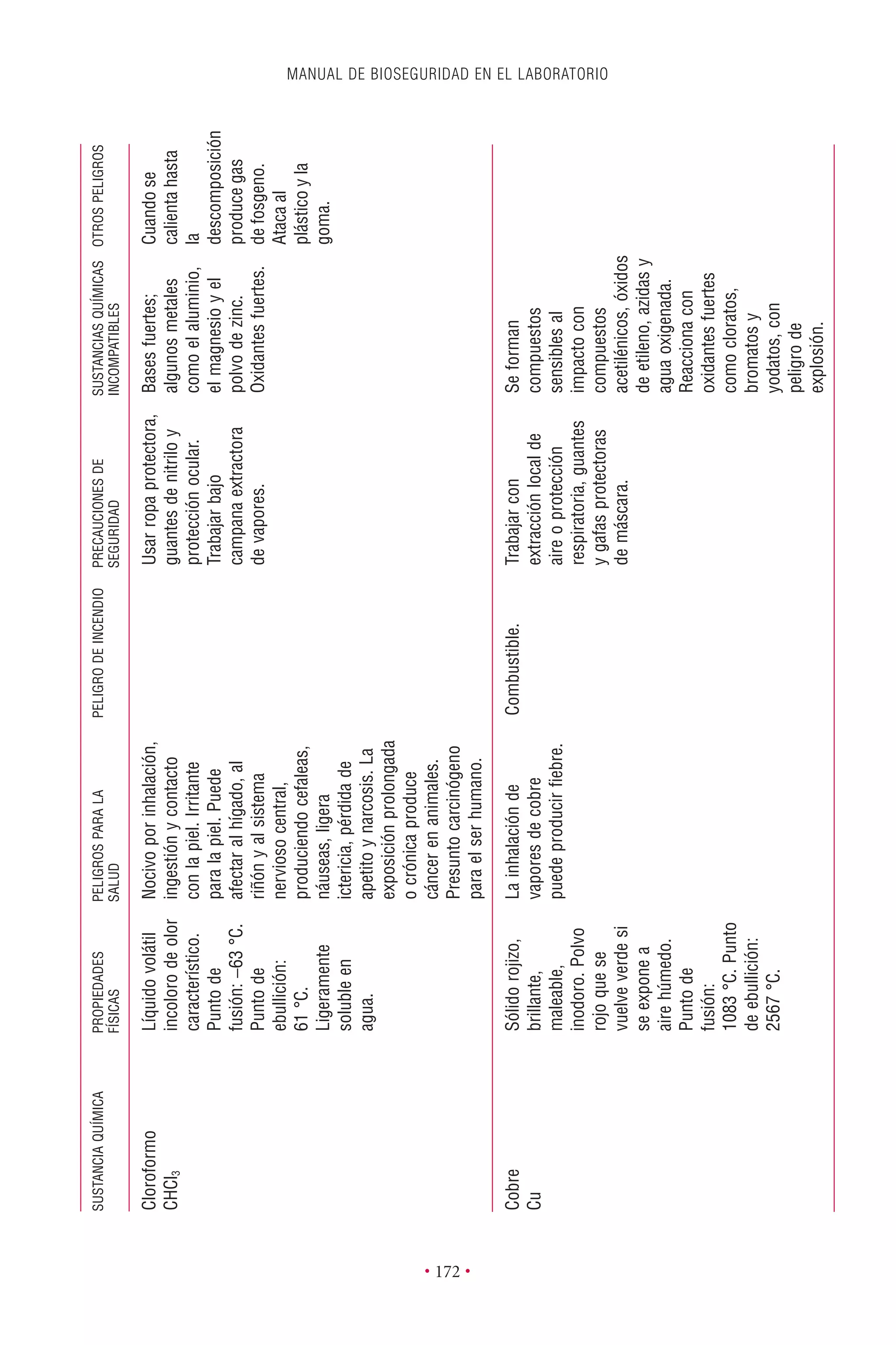
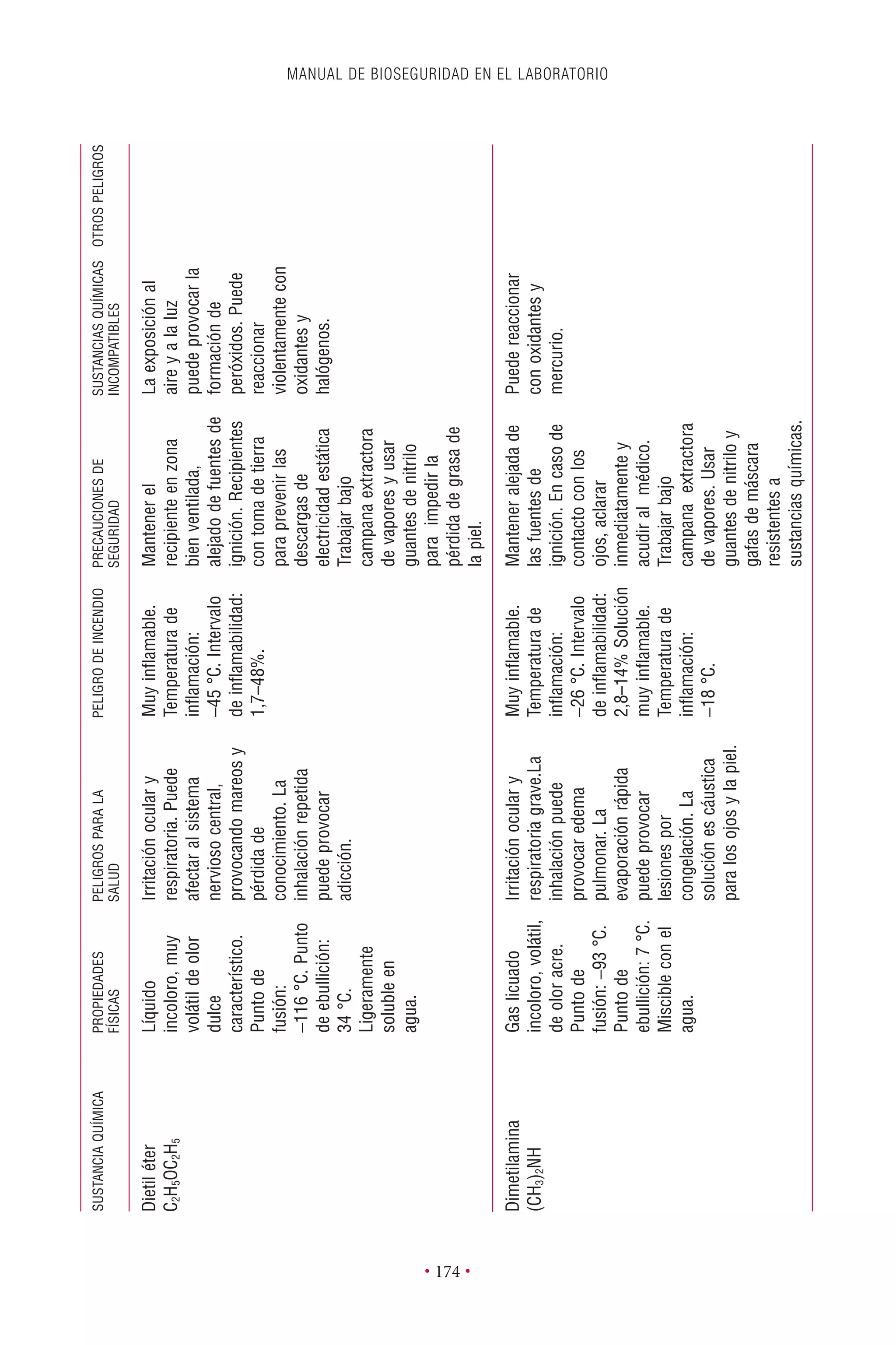
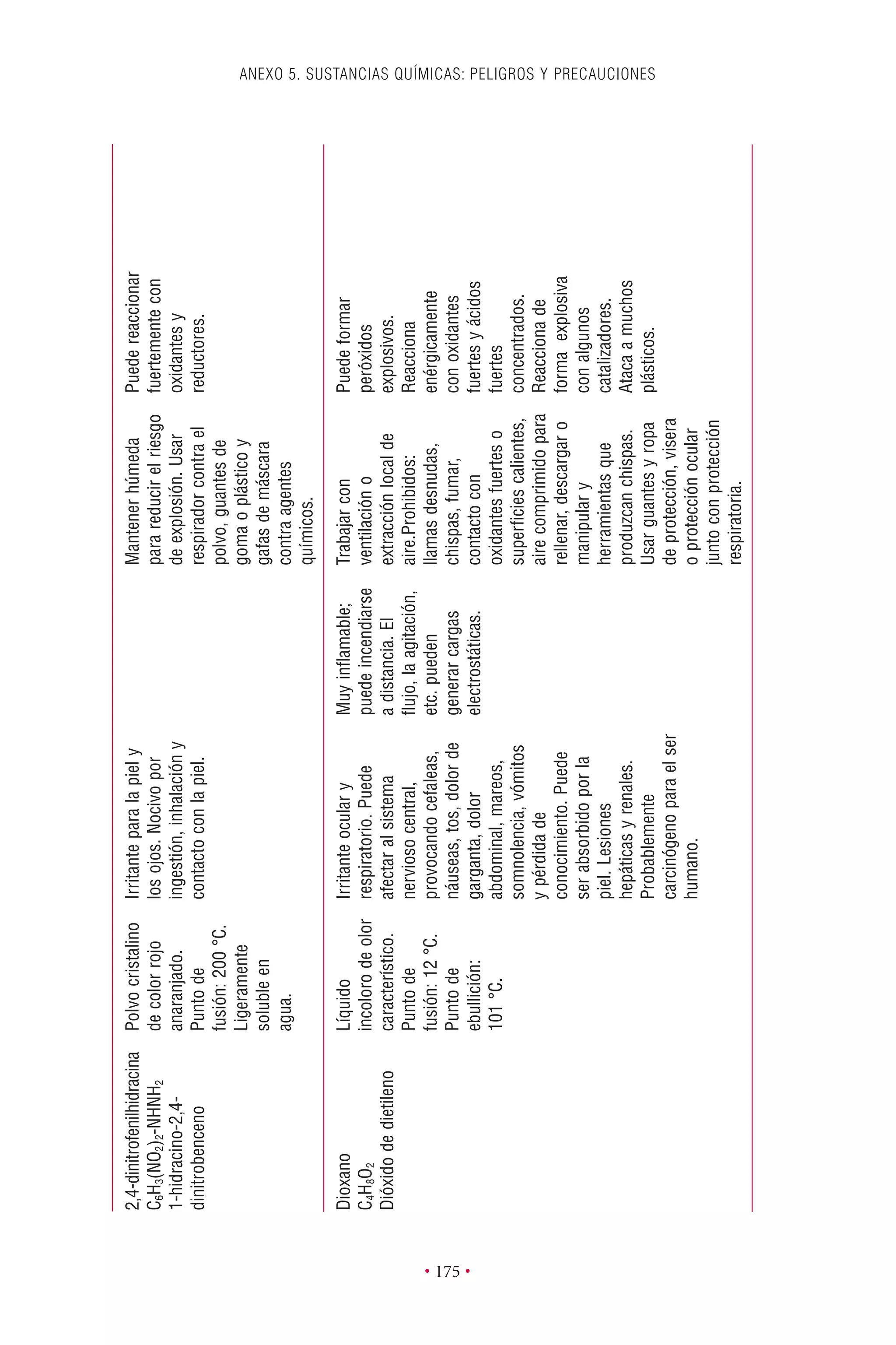
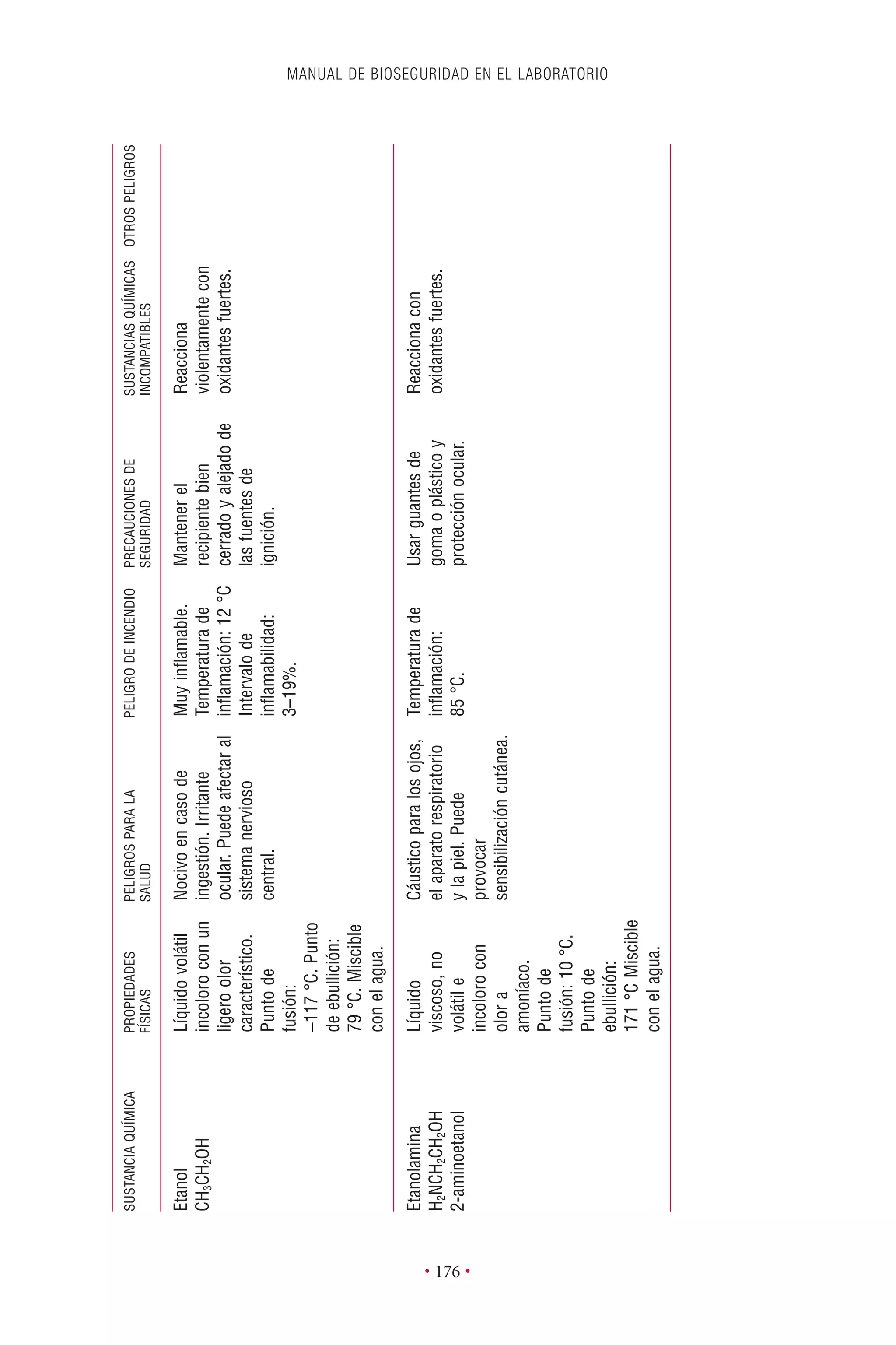
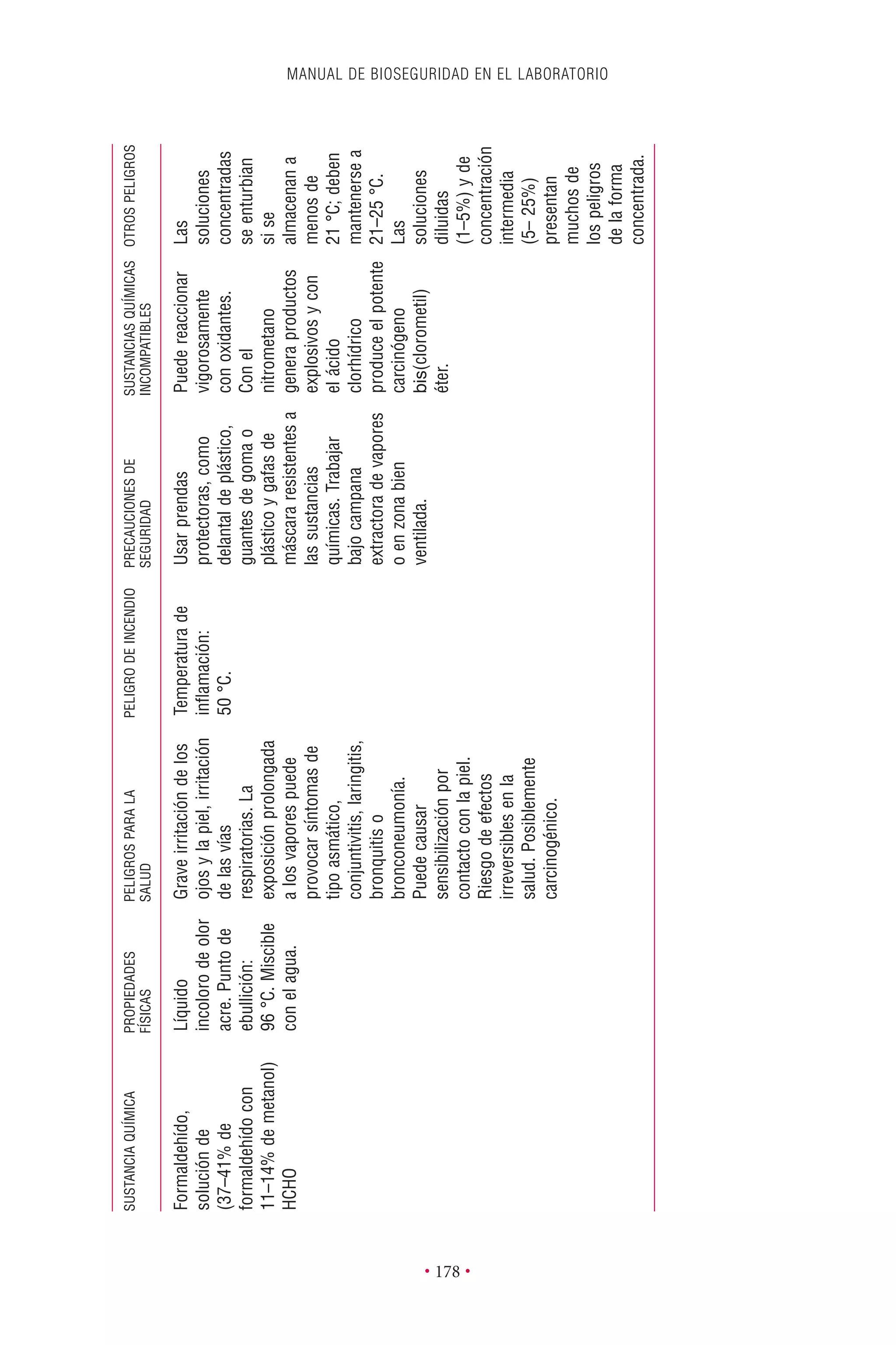
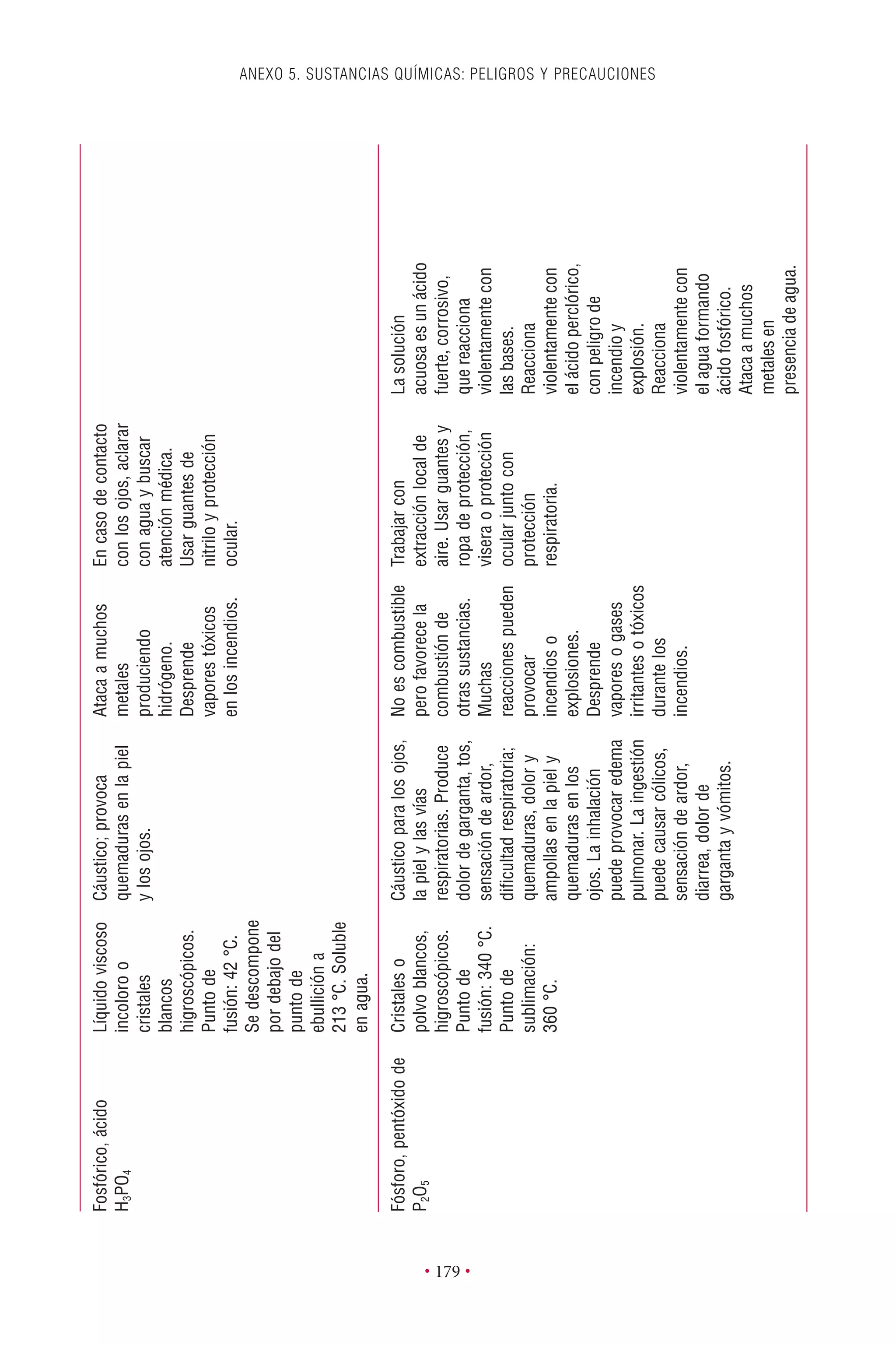
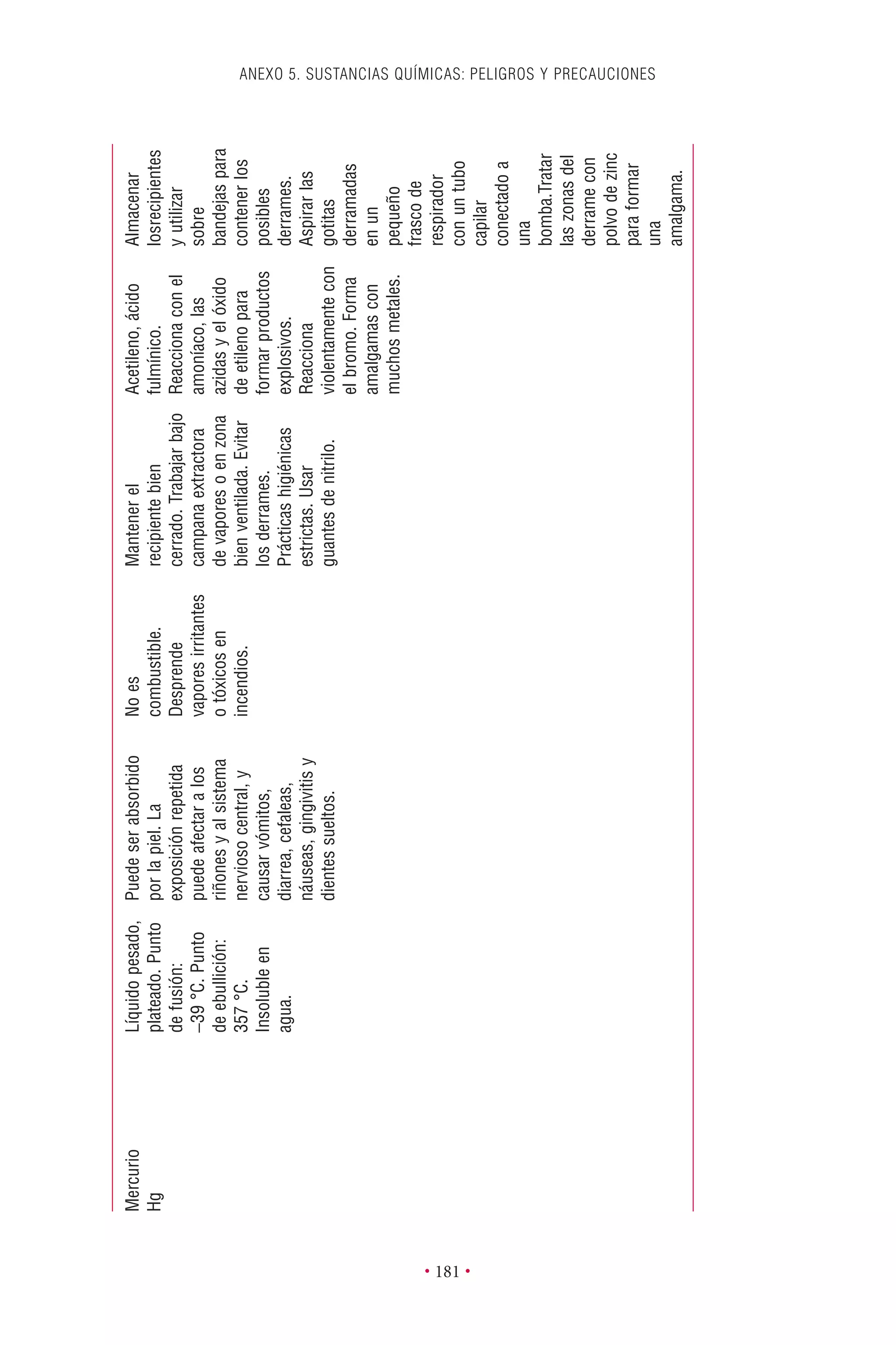
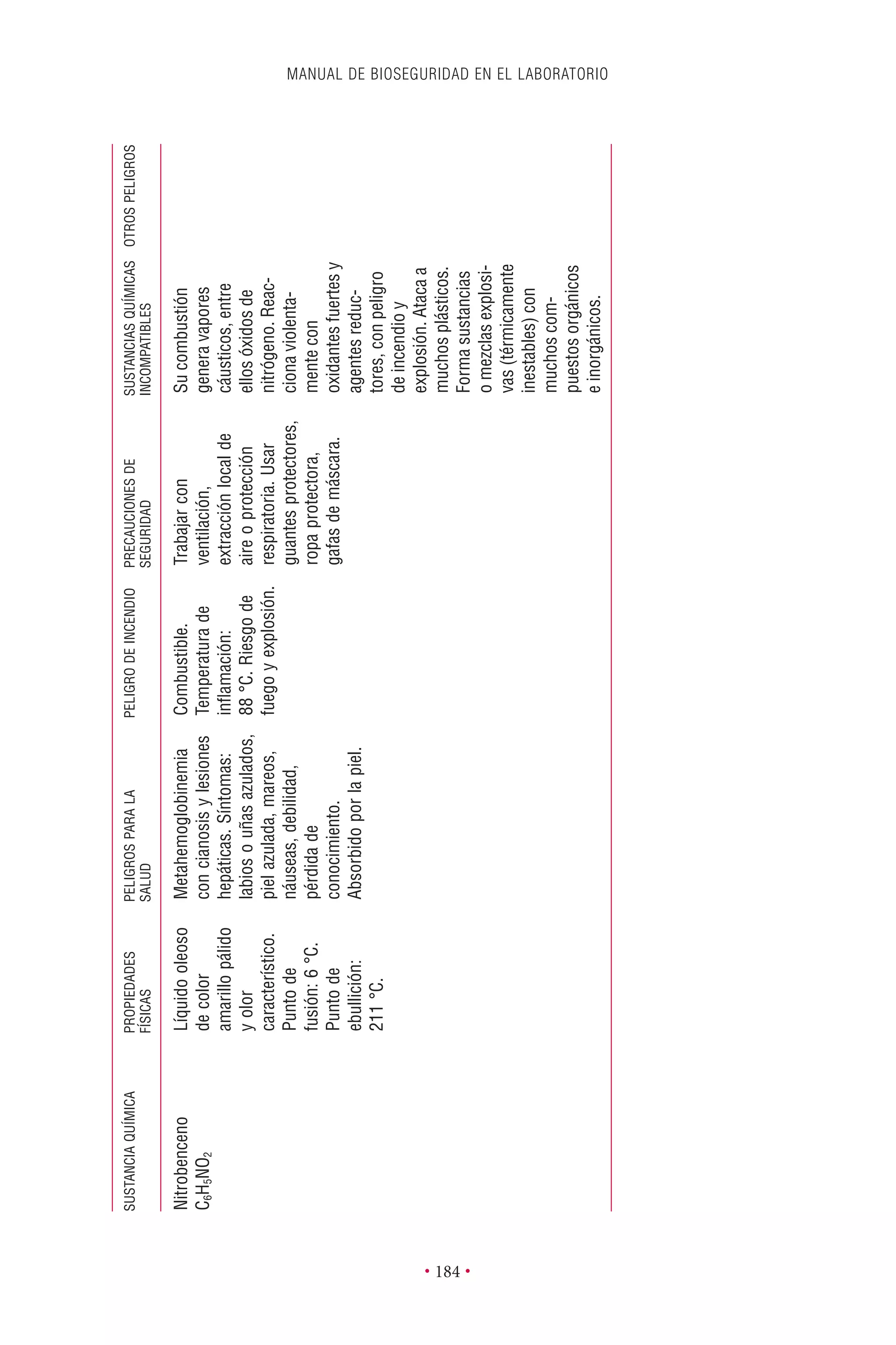
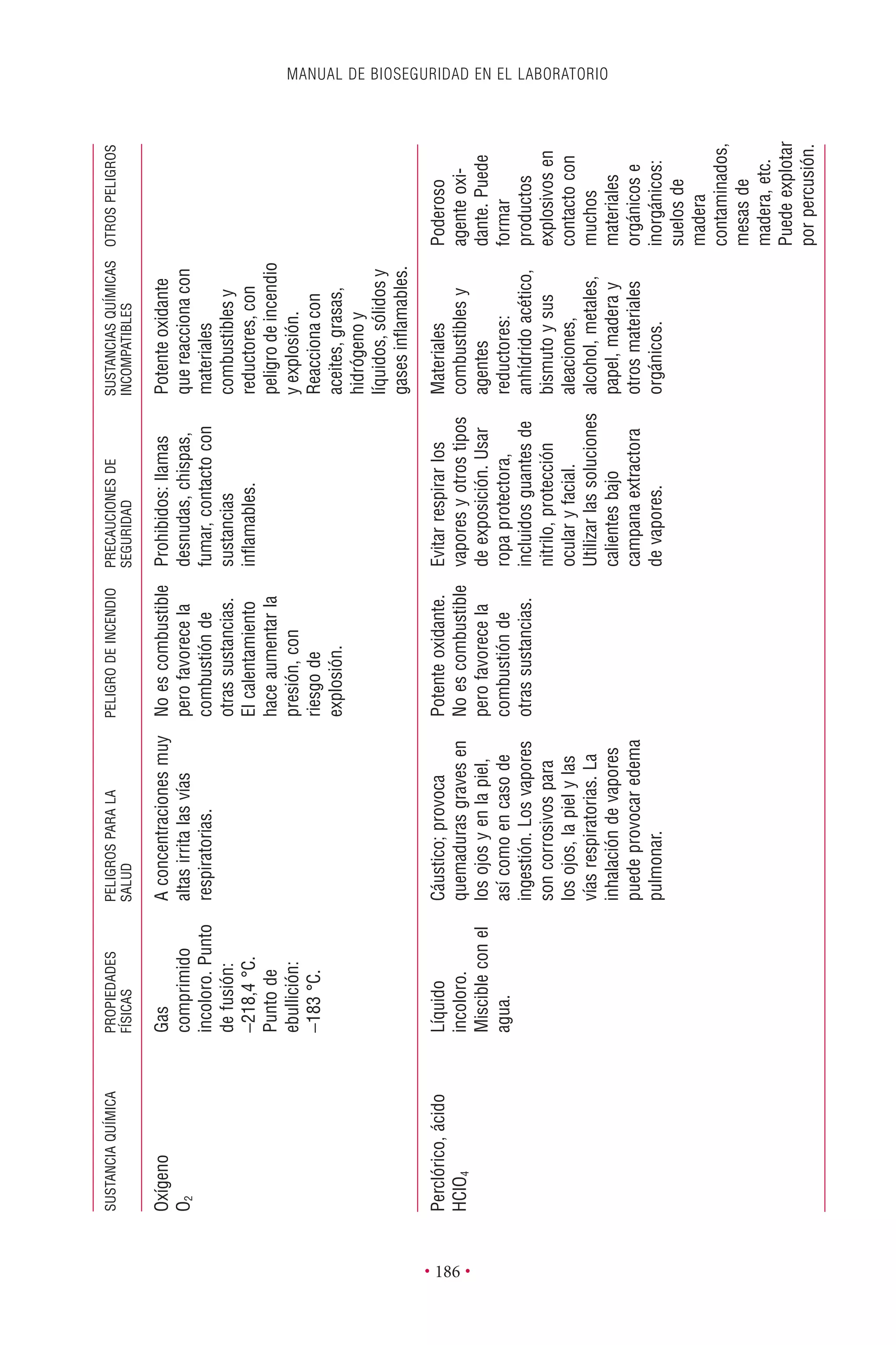
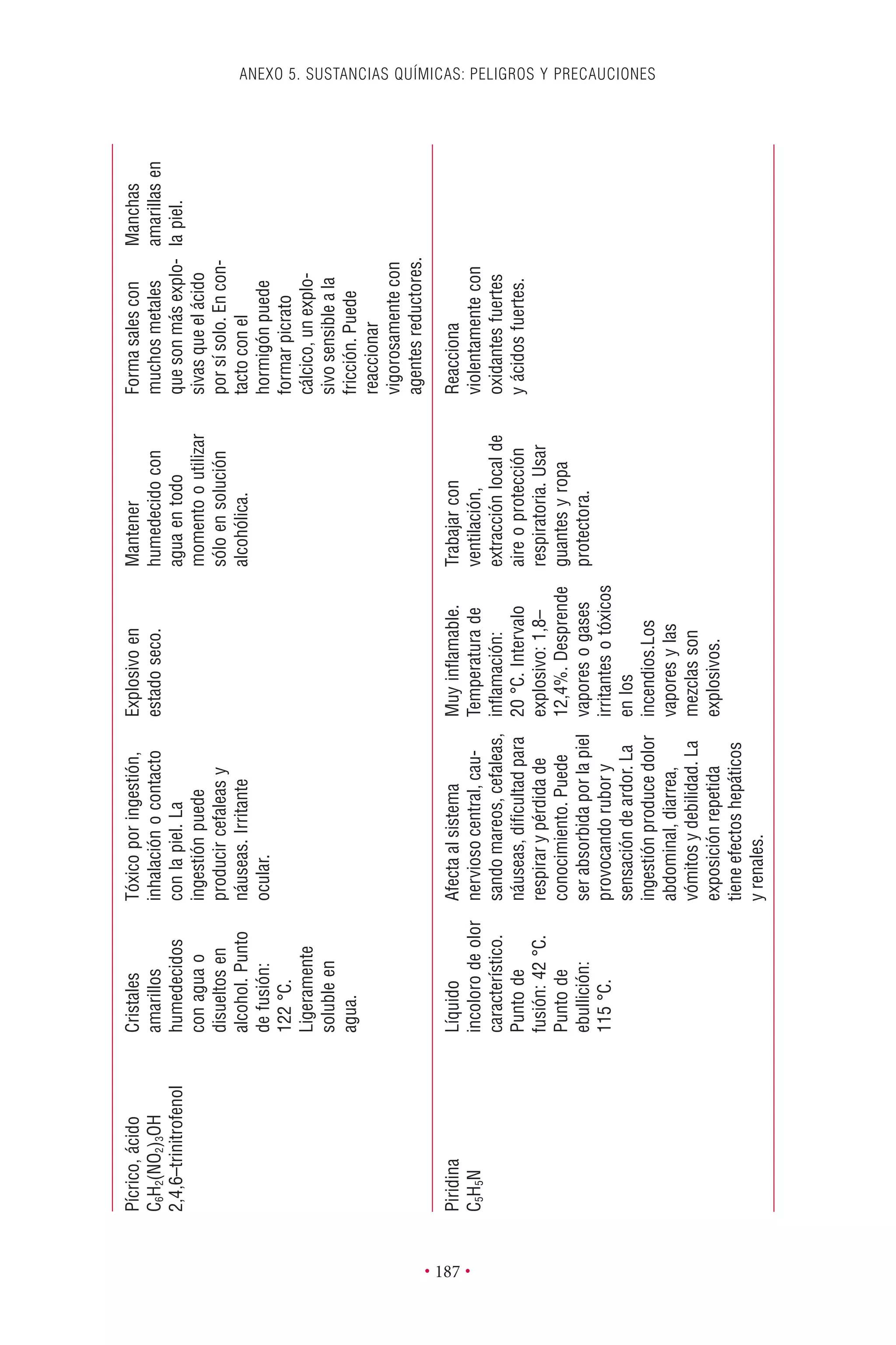
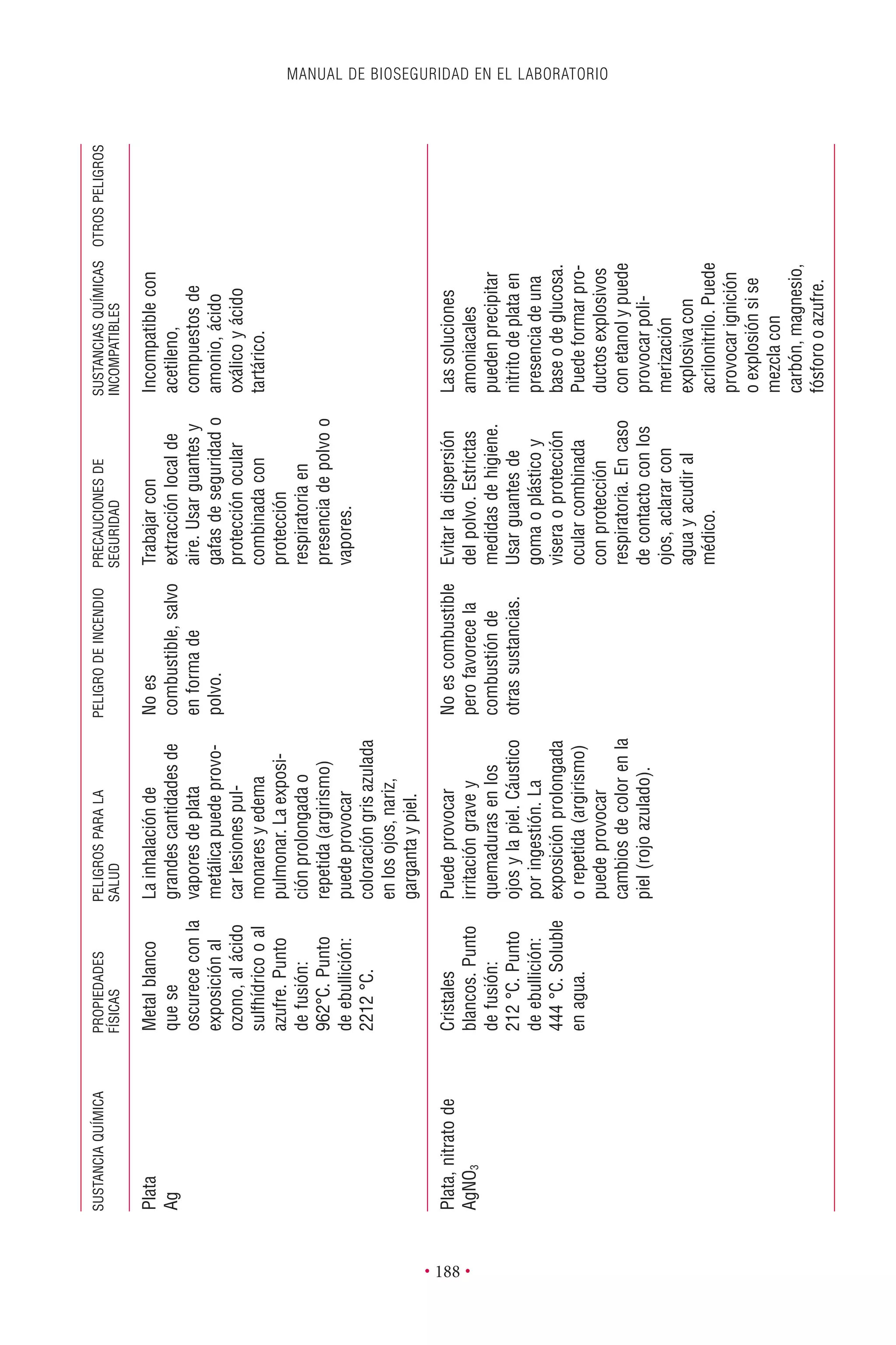
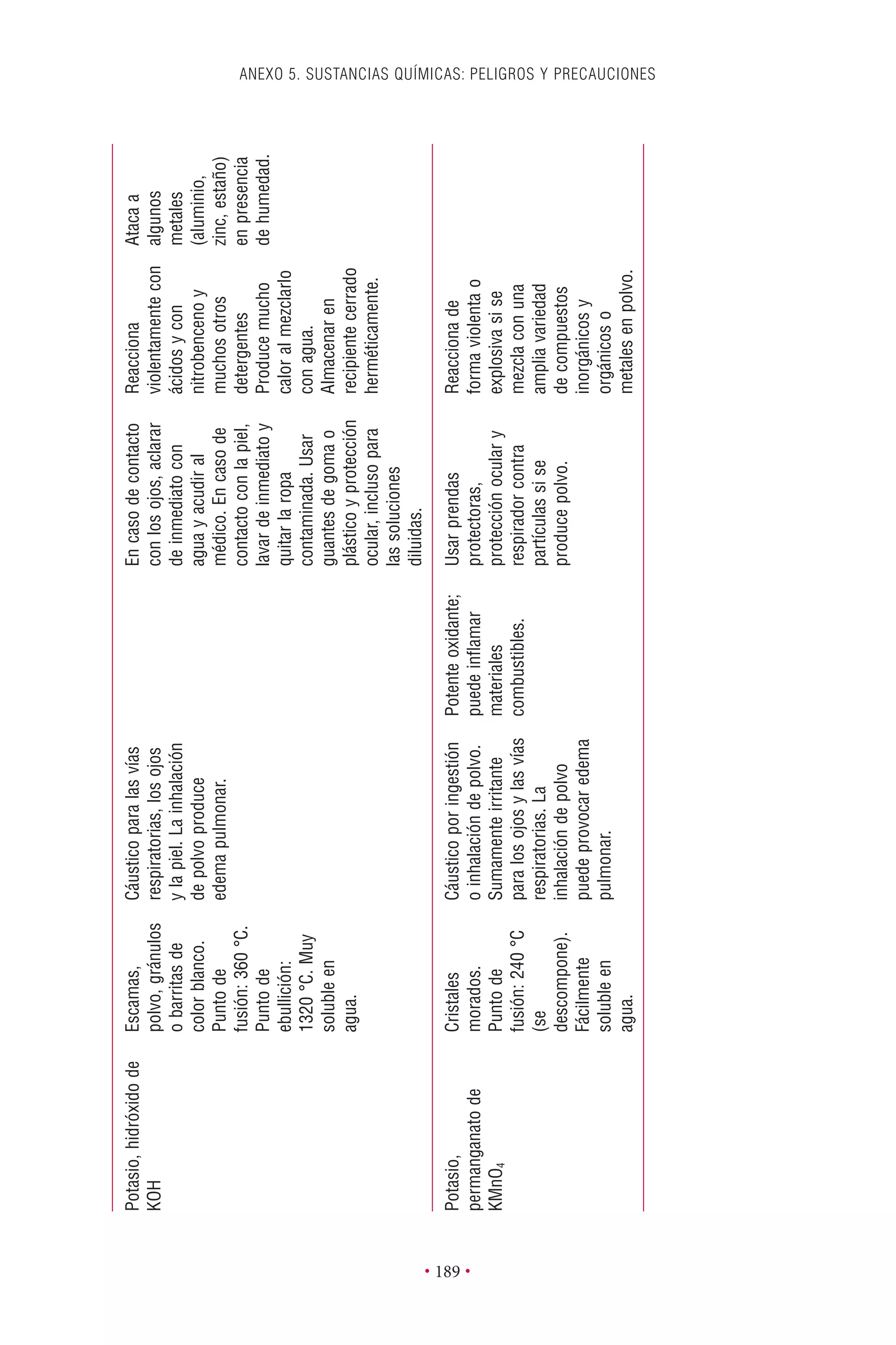
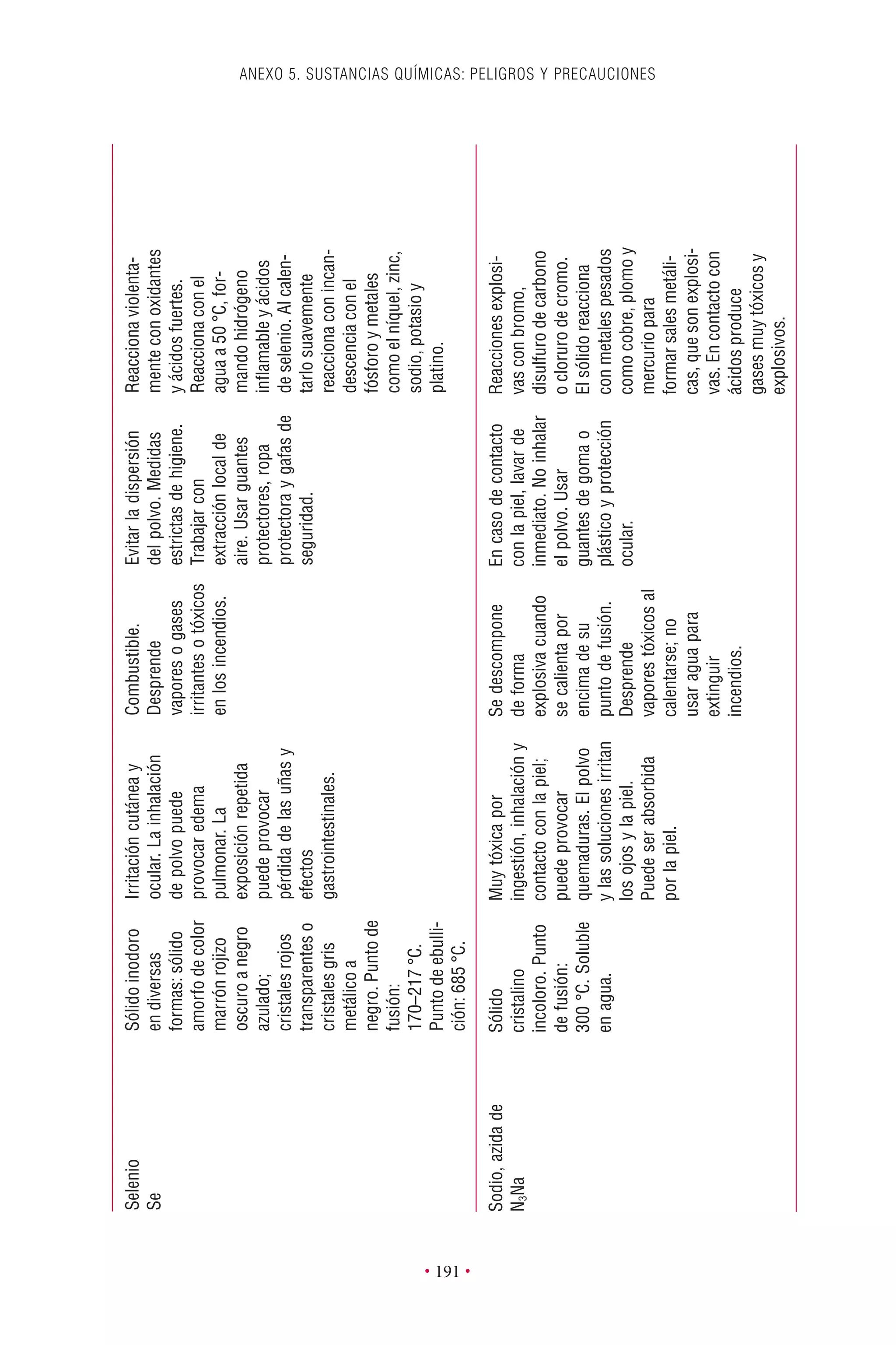
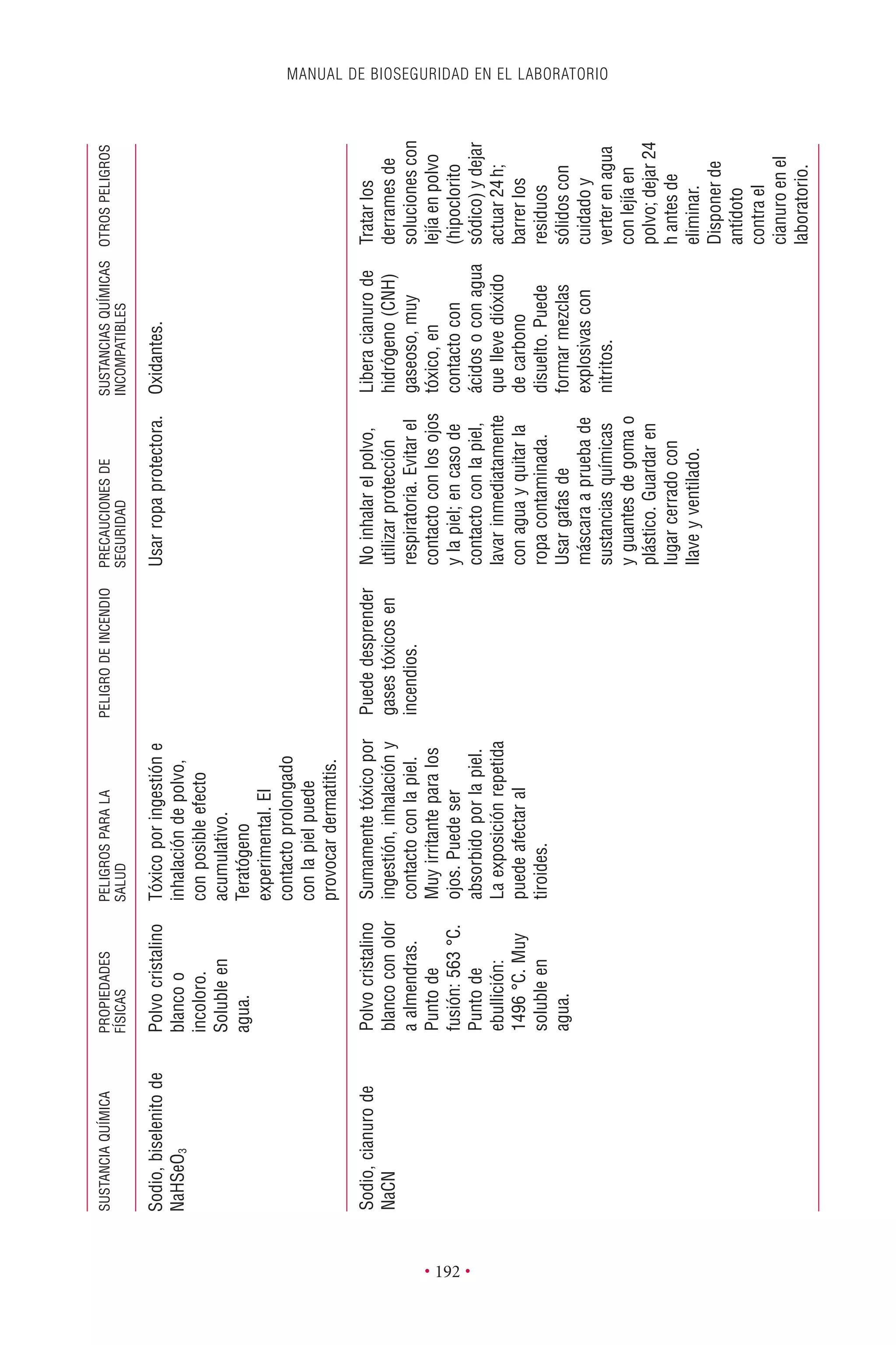
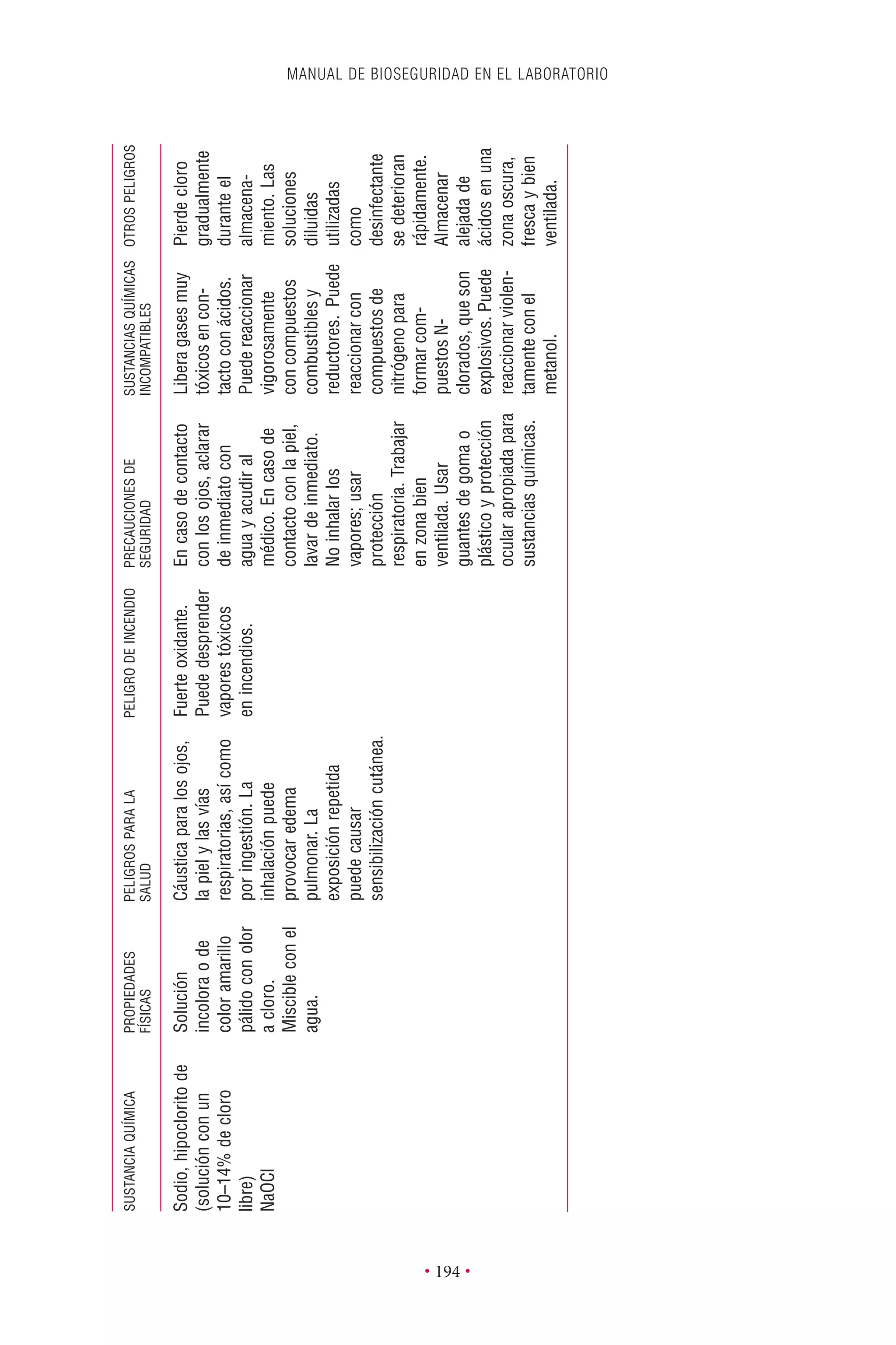
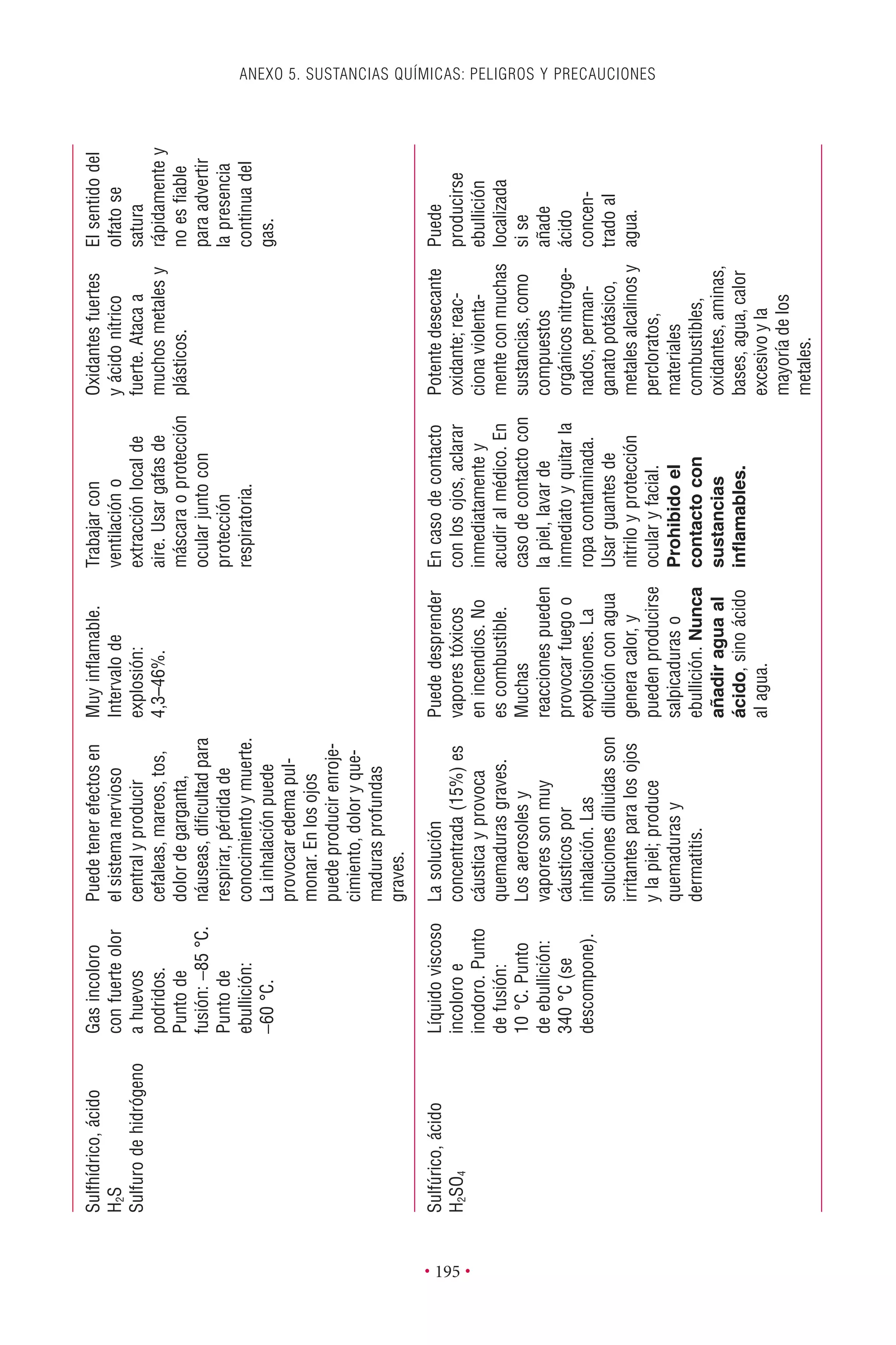
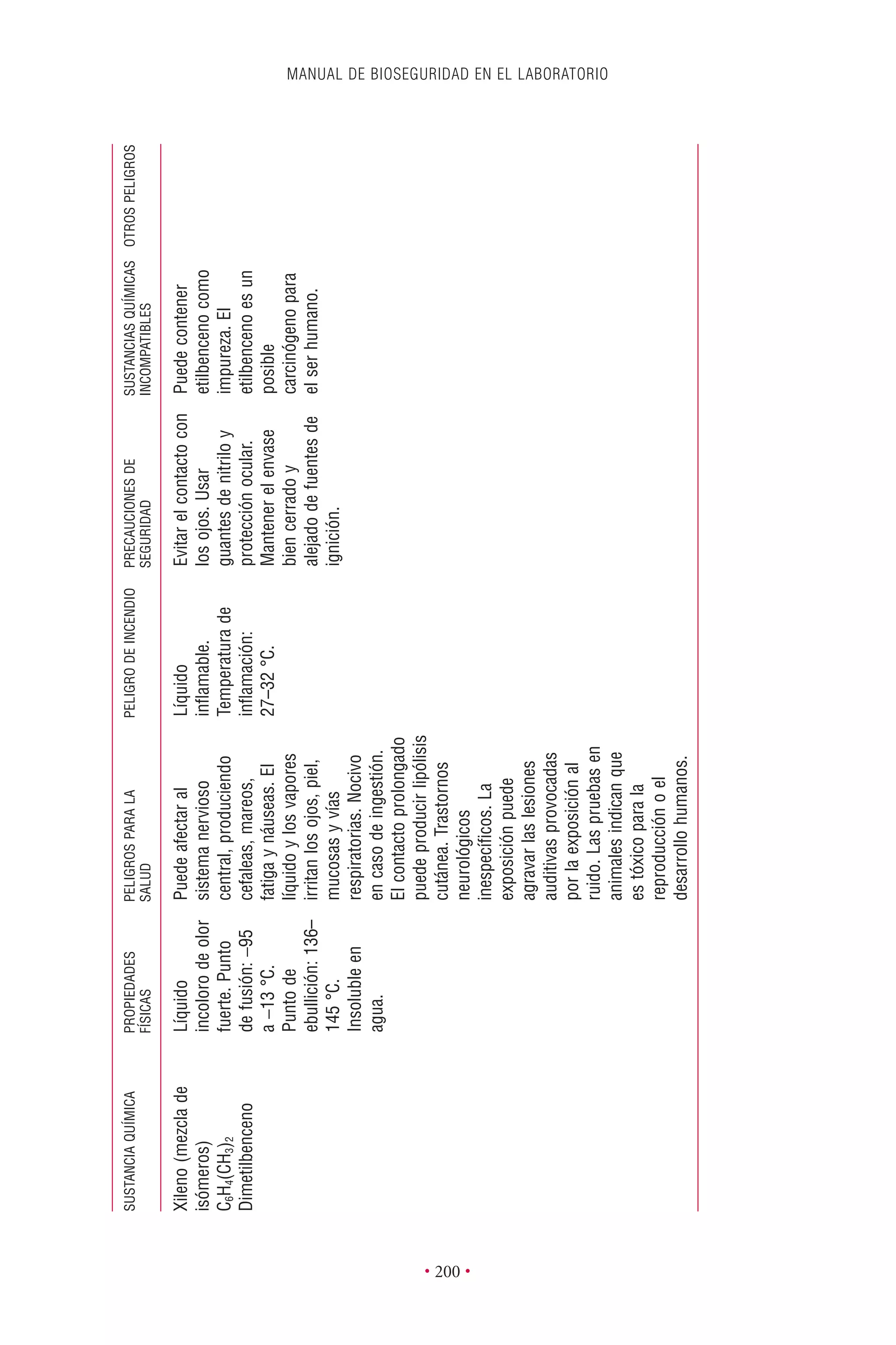
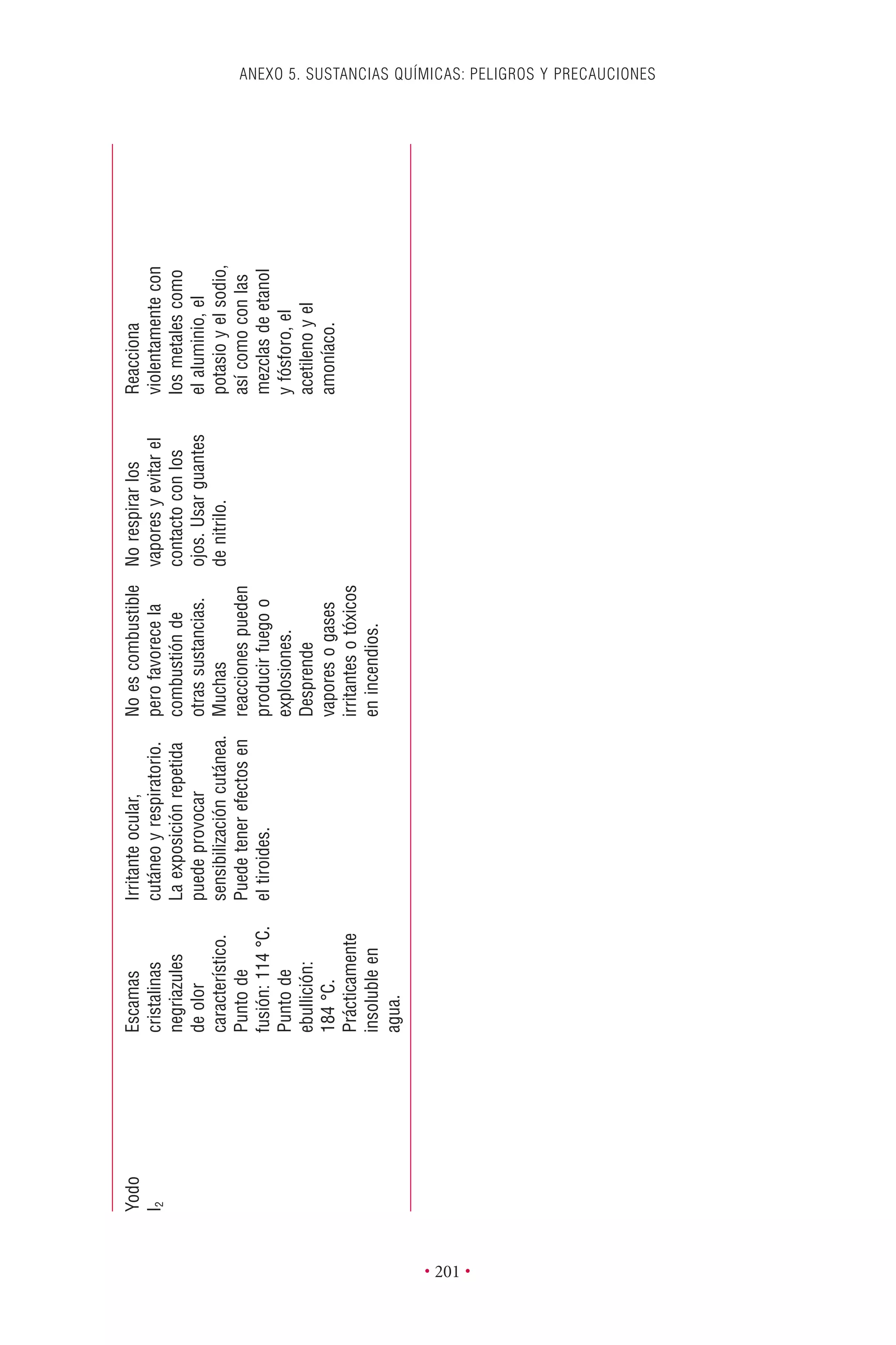
Este documento presenta la tercera edición del Manual de Bioseguridad en el Laboratorio publicado por la Organización Mundial de la Salud. El manual ha sido revisado y ampliado para abordar los nuevos desafíos en bioseguridad, como la evaluación de riesgos, el uso de la tecnología del ADN recombinante y las directrices para la certificación de laboratorios. El manual sigue siendo una guía fundamental para establecer programas de seguridad biológica en los laboratorios de todo el mundo.