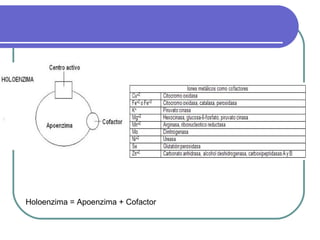
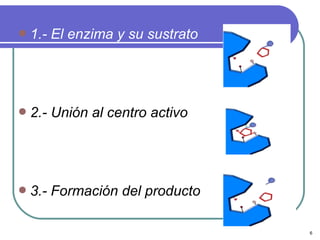
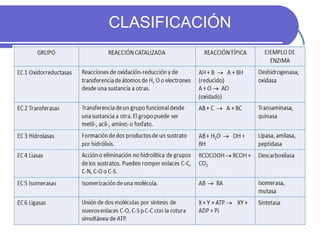
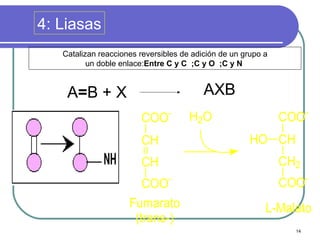
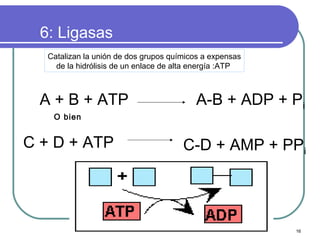
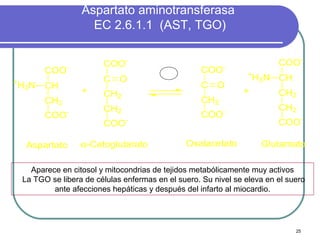
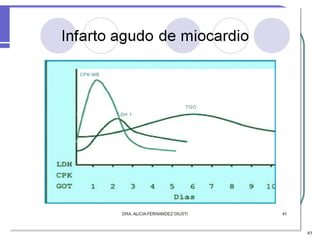
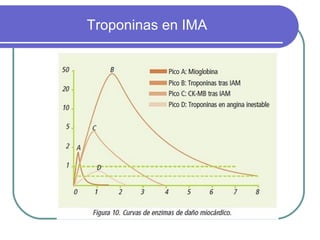
Este documento describe las enzimas clínicas y su importancia en el diagnóstico médico. Define las enzimas como biocatalizadores proteicos y explica su mecanismo de acción, clasificación y nomenclatura. También destaca varias enzimas como marcadores de lesiones tisulares, incluyendo las aminotransferasas, creatina kinasa, fosfatasa alcalina y alfa-amilasa.