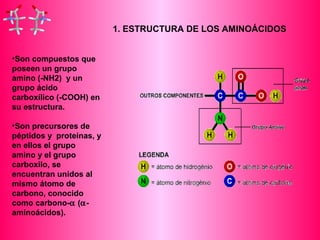
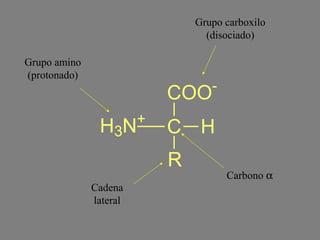
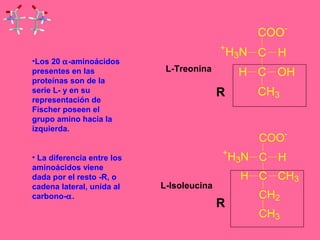
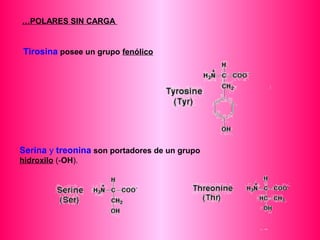
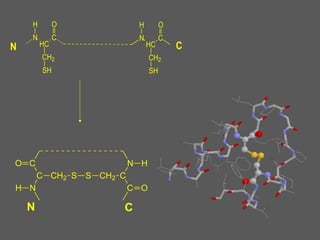
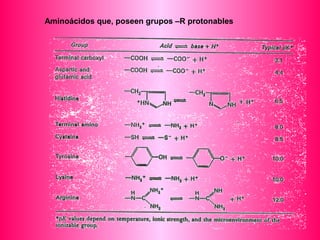
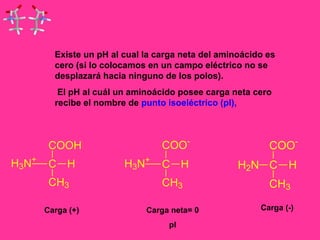
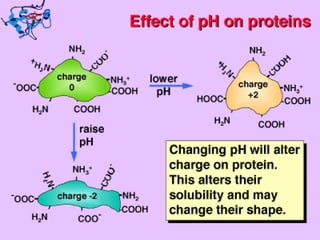
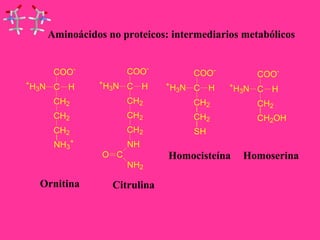
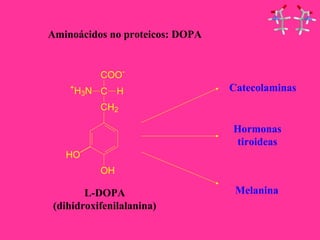
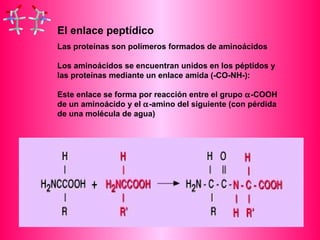
Este documento describe la función biológica de las proteínas y los aminoácidos que las componen. Explica que las proteínas están formadas por 20 aminoácidos comunes y describe las diferentes clasificaciones de los aminoácidos según su estructura y propiedades. También analiza la formación del enlace peptídico que une los aminoácidos en las cadenas proteicas.