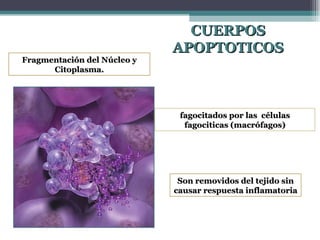
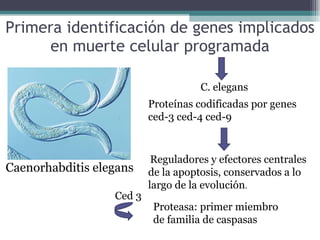
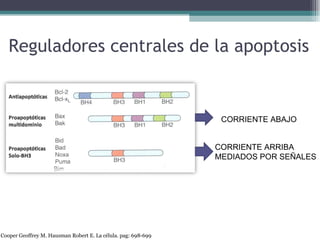
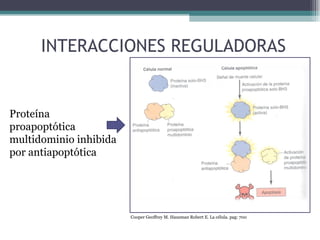
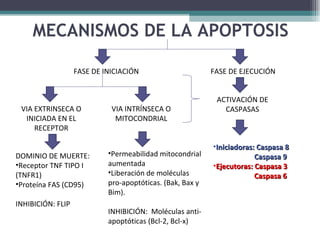
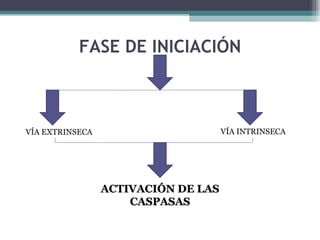
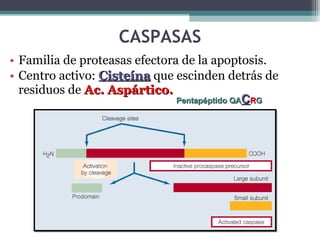
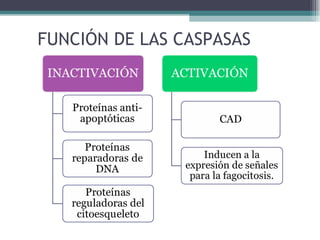
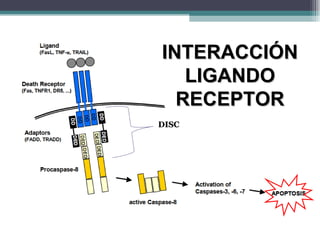
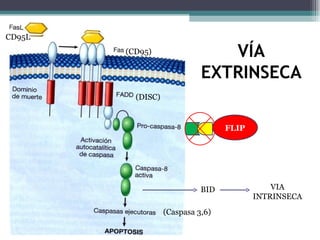
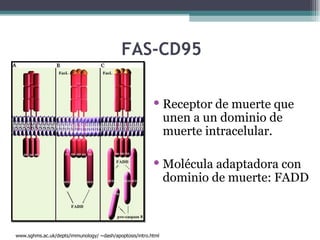
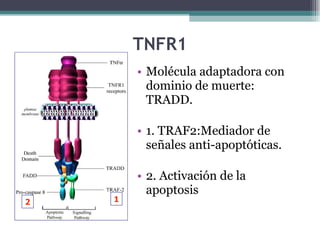
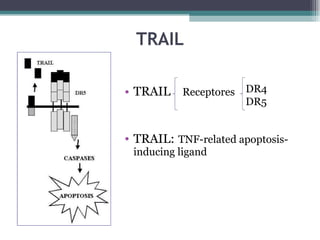
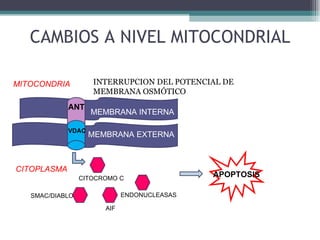
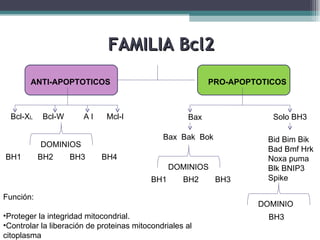
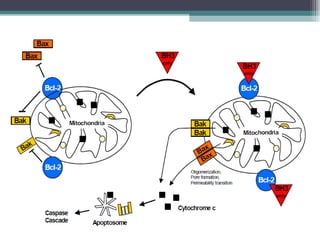
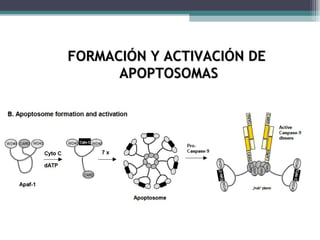
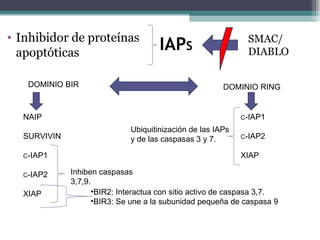
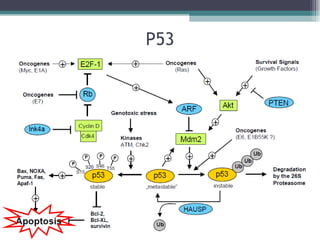
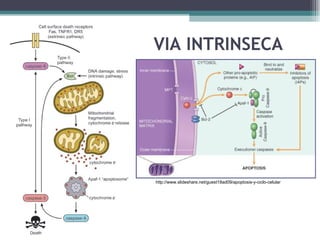
El documento resume los conceptos clave de la apoptosis o muerte celular programada. Explica que la apoptosis es un proceso genéticamente regulado de autodestrucción celular en respuesta a señales ambientales o de estrés. Describe las características morfológicas de la apoptosis y diferencia entre apoptosis y necrosis. Además, explica las vías y moléculas reguladoras clave de la apoptosis como la familia Bcl-2, caspasas y la formación del apoptosoma.