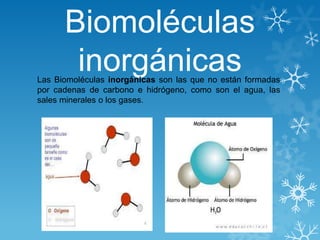
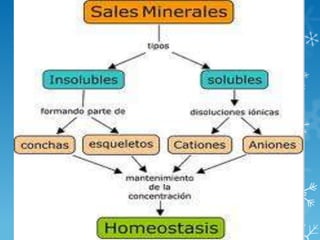
Las biomoléculas inorgánicas no contienen carbono e hidrógeno y incluyen el agua, sales minerales y gases. El agua es fundamental para la vida y se origina la vida en ella. Su estructura de molécula polar le permite formar puentes de hidrógeno entre moléculas y tiene propiedades como poder disolvente y mantener el estado líquido. Las sales minerales se encuentran como insolubles o solubles y cumplen funciones estructurales, fisiológicas y de regulación.