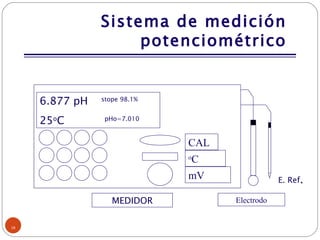
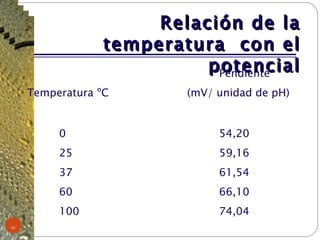
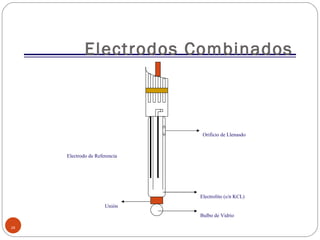
Este documento proporciona información sobre la metrología de pH. Define términos como instrumento de medición, patrón, material de referencia y explica conceptos como calibración y verificación. Describe los componentes del sistema de medición potenciométrico de pH y factores que afectan las mediciones como la temperatura. Finalmente, cubre temas como trazabilidad, buenas prácticas de laboratorio y criterios para realizar mediciones de pH.