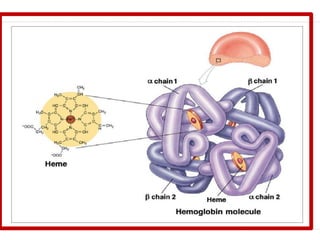
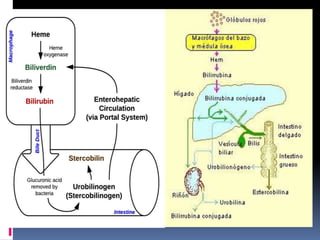
La hemoglobina está compuesta de cuatro cadenas polipeptídicas (dos alfa y dos beta) unidas a un grupo hemo que contiene hierro. Cada molécula de hemoglobina puede unirse a cuatro moléculas de oxígeno para transportarlo por el cuerpo. La hemoglobina se sintetiza en los eritrocitos poco antes de que estos salgan a la circulación como reticulocitos, y se degrada cuando los eritrocitos mueren luego de aproximadamente 120 días, siendo fagocitada y descomponiendo sus componentes