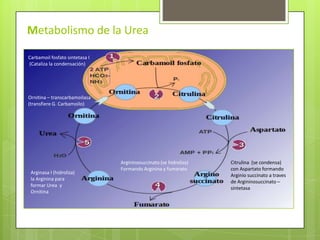
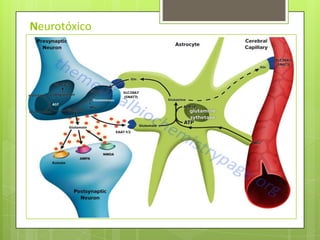
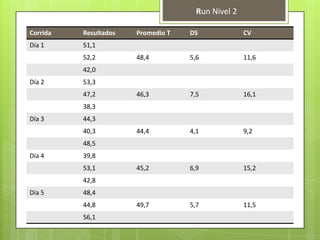
Este documento describe la determinación del nitrógeno ureico en sangre (BUN) mediante el método enzimático de ureasa/GLDH. Explica la fisiopatología del BUN, su importancia clínica, y los pasos para realizar la prueba en un analizador automático, incluyendo la recolección de muestras, controles de calidad y cálculos. El método demostró ser preciso y veraz para la cuantificación del BUN.