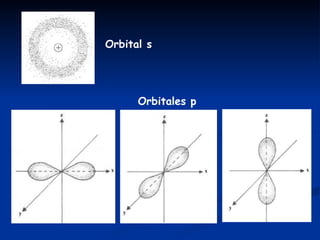
El modelo mecano-cuántico describe a los electrones como ondas cuya posición alrededor del núcleo solo puede determinarse probabilísticamente. Los electrones se agrupan en nubes electrónicas u orbitales definidos por tres números cuánticos. El actual modelo atómico propuesto por Schrödinger sintetiza las conclusiones de Bohr, De Broglie y Heisenberg.