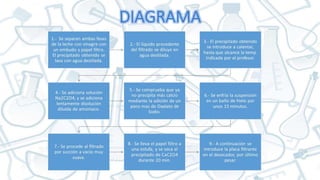
El documento detalla la práctica de laboratorio #6 sobre la determinación gravimétrica de calcio mediante la formación de oxalato de calcio a partir de soluciones alcalinas. Se presenta el procedimiento, cálculos y resultados de la cuantificación del contenido de calcio en muestras diversas, indicando que la leche es una fuente rica en este mineral. Los resultados obtenidos fueron 0.145 g/100 ml y 0.127 g/100 ml de calcio en las muestras analizadas.