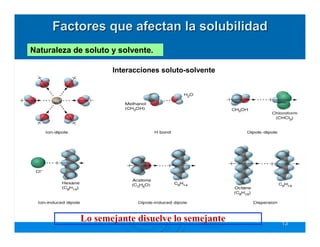
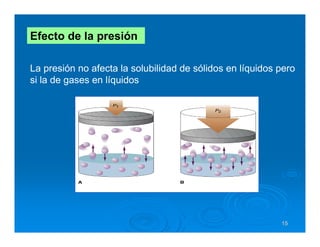
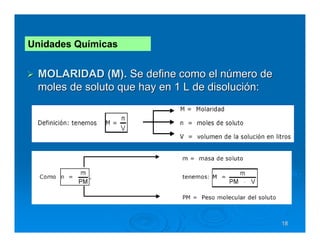
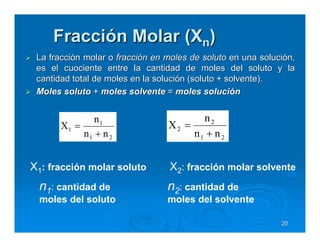
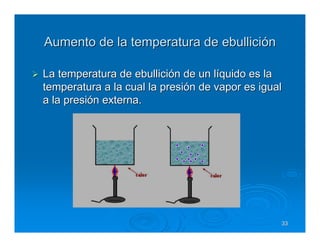
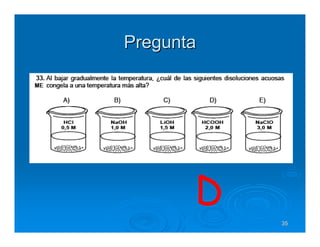
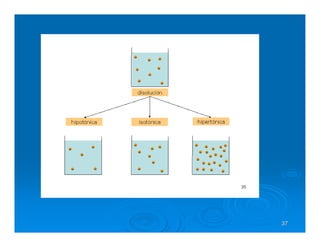
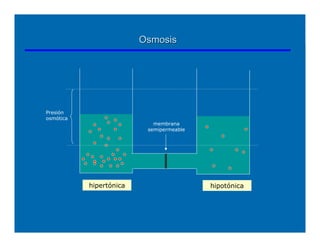
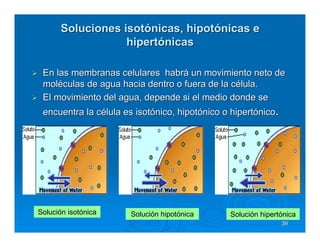
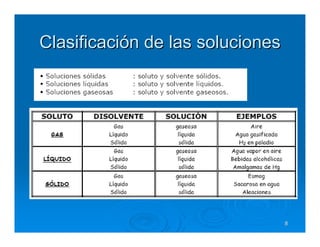
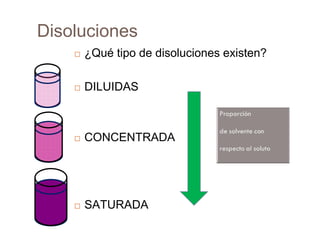
Este documento describe diferentes tipos de disoluciones químicas, incluyendo soluciones, coloides y suspensiones. Explica cómo se clasifican según el tamaño de las partículas dispersas y su estabilidad. También cubre conceptos como concentración, factores que afectan la solubilidad, y propiedades coligativas como la osmosis.









![Solubilidad
La solubilidad es la cantidad máxima de sustancia que
puede ser disuelta en una determinada cantidad de
disolvente a una temperatura dada. Puede ser expresada
en g/L o [ ] molar.
Clasificación.
12](https://image.slidesharecdn.com/disolucionesqm2010-100813105309-phpapp01/85/Disoluciones-qm-2010-12-320.jpg)