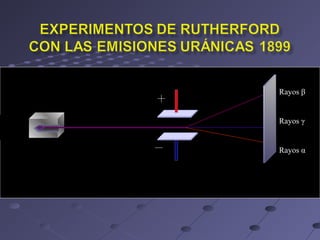
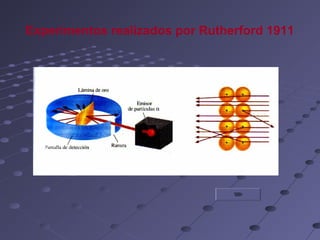
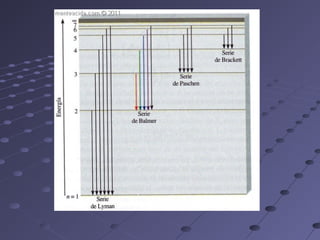
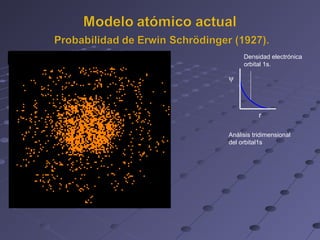
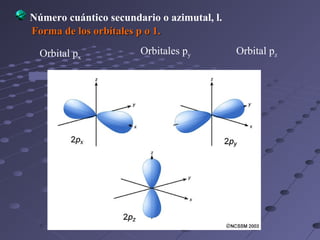
Este documento describe los modelos atómicos de Thomson, Rutherford y Bohr. Thomson propuso que los átomos estaban compuestos de una esfera de carga positiva con electrones dispersos en ella. Rutherford determinó que la mayor parte de la masa de un átomo está concentrada en un núcleo central positivo. Bohr sugirió que los electrones orbitan al núcleo en órbitas definidas.