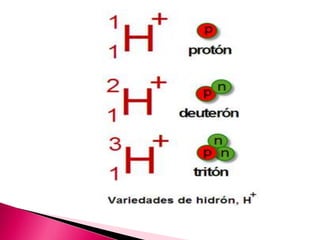
El documento proporciona definiciones de términos relacionados con el pH y la acidez/basicidad de las soluciones, incluyendo pH, pOH, ácidos, bases, acidez, basicidad, ácidos y bases fuertes y débiles, iones de hidrógeno e hidroxilo, indicadores ácido-base y pHmetros. Explica que el pH mide la concentración de iones hidronio y que el pOH está relacionado con la concentración de iones hidroxilo. Además, define qué son los ácidos,




![ El POH se define como el logaritmo negativo
de la actividad de los iones de hidróxido. Esto
es, la concentración de iones OH:
pOH = − log10.[OH − ]
En soluciones acuosas, los iones OH-
provienen de la disociación del agua:
H2O H+ + OH-
O también,
2H2O H3O+ + OH-](https://image.slidesharecdn.com/elph-180424005354/85/EL-PH-5-320.jpg)