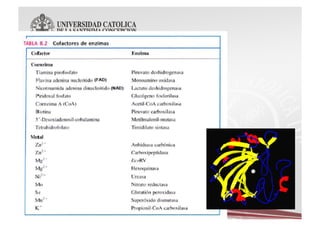
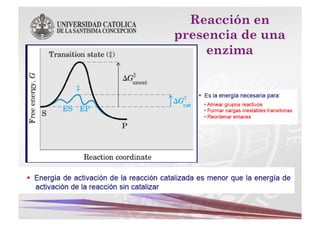
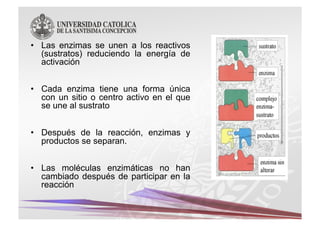
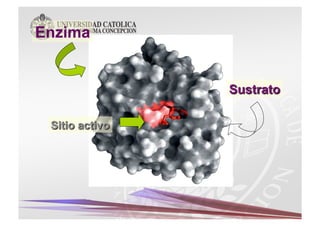
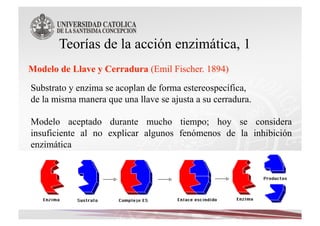
Este documento describe las características y funciones de las enzimas. Las enzimas son proteínas que actúan como catalizadores de las reacciones químicas en los sistemas biológicos. Disminuyen la energía de activación de las reacciones, acelerando así su velocidad. Funcionan uniéndose específicamente a sus sustratos y creando un ambiente que favorece la reacción química en su sitio activo. Luego se separan de los productos sin haber cambiado ellas mismas.