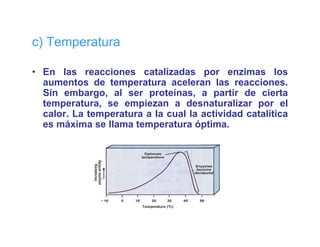
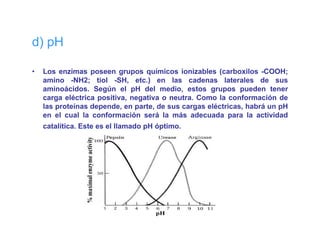
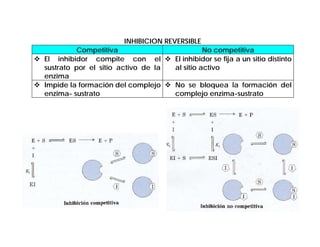
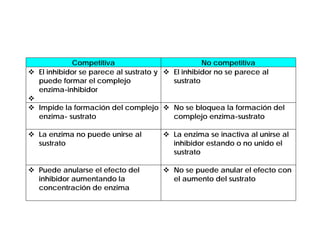
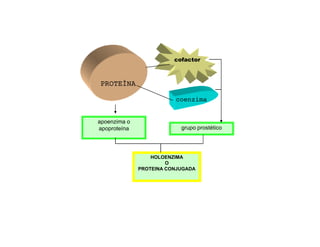
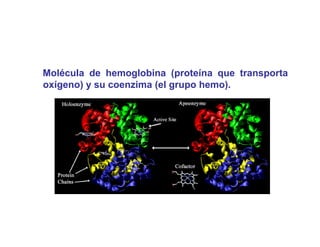
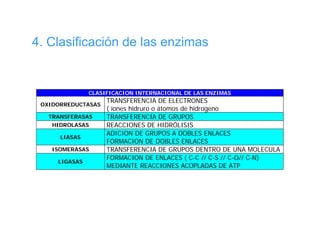
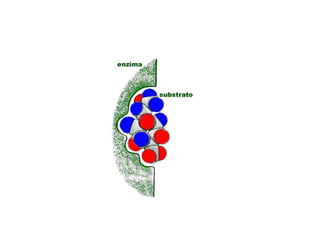
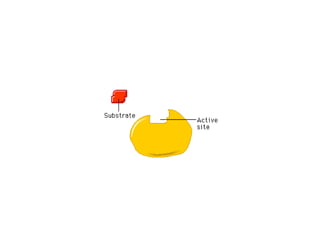
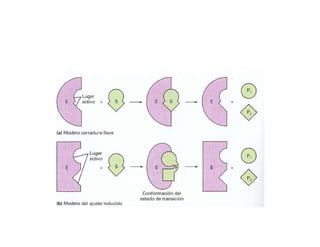
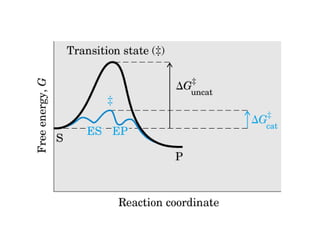
El documento describe las características generales de los enzimas. Los enzimas son proteínas que catalizan reacciones químicas y aceleran las reacciones que pueden ocurrir espontáneamente. Los enzimas funcionan de manera específica y óptima sólo dentro de un rango limitado de temperatura y pH.









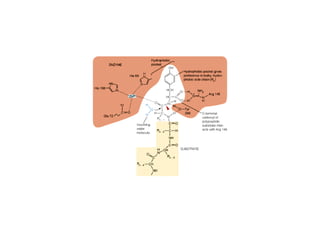





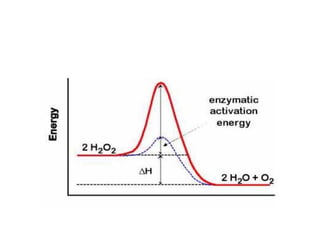
![LOS GRUPOS Pueden interactuar de manera
transitoria con un sustrato activándolo
CATÁLITICOS DE
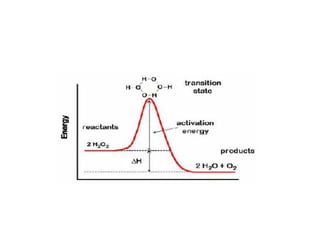
UNA ENZIMA Disminuyen la energía de activación
( CADENAS LATERALES DE LOS de una reacción al proporcionar una
AMINOACIDOS, IONES, COENZIMAS)
ruta alternativa de menor energía
g
La energía requerida para disminuir la
energía de activación proviene
generalmente de las interacciones débiles
no covalentes entre sustrato y enzima
la formación del [ES] viene
acompañada de una pequeña liberación de
energía libre
ENERGÍA DE FIJACIÓN
Es la principal fuente de energía libre para
disminuir la energía de activación de las
reacciones](https://image.slidesharecdn.com/presentacion-enzimas-enf-2010-100901200316-phpapp01/85/Enzimas-Enfermeria-2010-24-320.jpg)
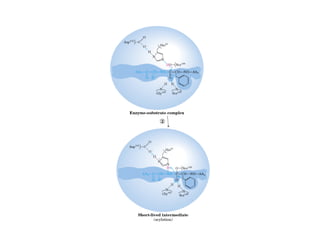
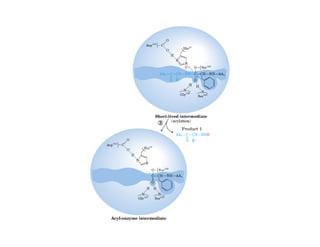
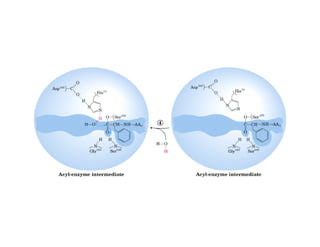
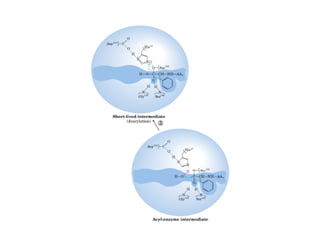
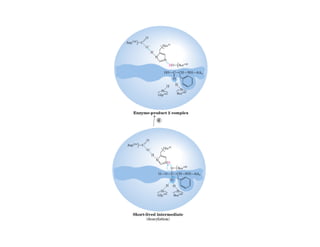
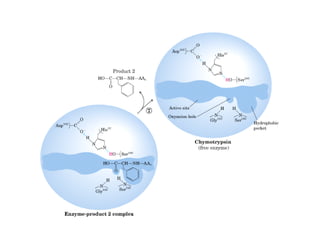

![b) Concentración de sustrato
• Uno de los factores clave que afectan a la velocidad
q
de una reacción catalizada por una enzima es la
cantidad de sustrato presente, [S].](https://image.slidesharecdn.com/presentacion-enzimas-enf-2010-100901200316-phpapp01/85/Enzimas-Enfermeria-2010-36-320.jpg)
![• La forma hiperbólica de esta curva se puede
p p
expresar algebraicamente mediante la ecuación de
Michaelis- Menten:
V * [S]
V = max
o Km + [S]
• donde
Vmax = Velocidad máxima
Vo = Velocidad inicial
[S] = Concentración del sustrato
Km = Constante de Michaelis-Menten](https://image.slidesharecdn.com/presentacion-enzimas-enf-2010-100901200316-phpapp01/85/Enzimas-Enfermeria-2010-37-320.jpg)
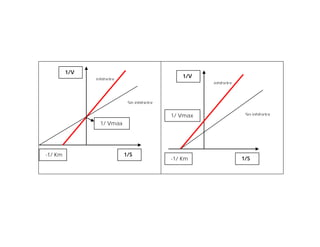
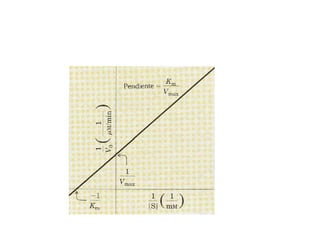
![• Esta ecuación se puede transformar a una forma
p
más útil de representar los datos experimentales, la
ecuación denominada ecuación de Lineweaver-Burk
1 Km 1 1
= * +
V
o
V
max
[S] Vmax
• Para las enzimas que obedecen la relación de
Michaelis-Menten la gráfica de 1/Vo frente a 1/[S] da
una línea recta](https://image.slidesharecdn.com/presentacion-enzimas-enf-2010-100901200316-phpapp01/85/Enzimas-Enfermeria-2010-38-320.jpg)
![Km UN PARÁMETRO CINÉTICO IMPORTANTE
• Para poder comparar una enzima con otra en cuanto
p p
a su poder catalítico debe estandarizarse al estado
estacionario
• En el estado estacionario la velocidad de formación
y desaparición del complejo ES se igualan.
S + E ↔[ES]→ E+P
K2
k1
k-1
• Se establece que Km = (k-1+k2)/k1](https://image.slidesharecdn.com/presentacion-enzimas-enf-2010-100901200316-phpapp01/85/Enzimas-Enfermeria-2010-40-320.jpg)
![• Km es una relación de constantes de velocidad para
p
una determinada reacción.
• Km es la concentración de sustrato para la cual la
velocidad de reacción es la mitad de la velocidad
máxima. En efecto, si Km = [S], la ecuación de
Michaelis-Menten se reduce a: v = Vmax/2.
• El valor de Km da idea de la afinidad de la enzima
por el sustrato: A menor Km, mayor afinidad de la
enzima por el sustrato, y a mayor Km, menor
afinidad.](https://image.slidesharecdn.com/presentacion-enzimas-enf-2010-100901200316-phpapp01/85/Enzimas-Enfermeria-2010-41-320.jpg)