1) La cinética enzimática cooperativa implica que una enzima tiene más de un sitio de unión para el sustrato por molécula enzimática.
2) La cooperatividad positiva ocurre cuando la unión del primer sustrato favorece la unión del siguiente, mientras que la cooperatividad negativa dificulta la unión subsiguiente.
3) Los modelos concertado y secuencial explican la cooperatividad a través de cambios conformacionales en la enzima inducidos por la unión del sustrato que afectan la afinidad







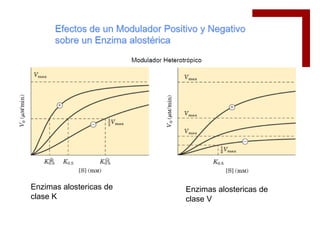
![Tratamiento de Hill
Aplicada a las enzimas con cinética sigmoidal
v
Saturación de la
Y = ------------
enzima [Po2]nh
Vmax Y = ---------------
K` + [Po2]nh
Snh S0,5 Concentración substrato la saturación
es igual ½ Vmax
Y = -------------
nh igual a 1 es una saturación hiperbólica michaeliana
Snh + Snh 0,5 S0,5 = Km
S v S
Y = ----------- = ------------ = -----------
S0,5 + S Vmax Km + S
nh>1 Cooperatividad positiva
nh<1 Cooperatividad negativa](https://image.slidesharecdn.com/enzimasvov-120519203854-phpapp02/85/Enzimas-vo-v-8-320.jpg)
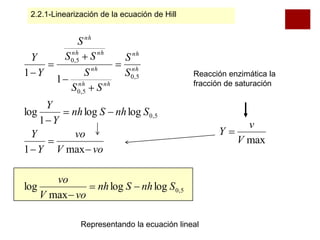
![La ecuación de una recta pendiente es el índice de Hill
vo Log[S0,5]
log
V max vo
pendiente = nHill
0
Obtención valor experimental del índice de Hill nos
permite deducir la existencia de cooperatividad.
nH indica cuántas de las zonas de unión de sustrato
de una enzima afectan a la afinidad de la unión del
sustrato en el resto de las zonas de unión.
log [S]
S0,5 Concentración substrato para la cual la saturación es igual a ½ de la velocidad
máxima](https://image.slidesharecdn.com/enzimasvov-120519203854-phpapp02/85/Enzimas-vo-v-10-320.jpg)


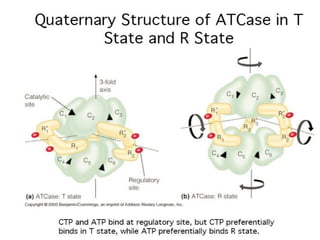
![Regulación Alostérica de la función enzimática
•La velocidad de una reacción enzimática depende de la
formación del complejo [ES].
¿ Es posible regular la actividad enzimática,
modificando la interacción enzima-sustrato?](https://image.slidesharecdn.com/enzimasvov-120519203854-phpapp02/85/Enzimas-vo-v-13-320.jpg)


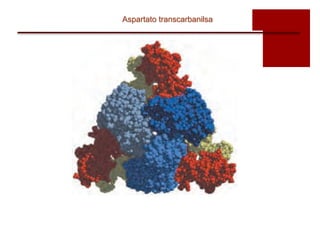
![- Monod, Changeux and Jacob (1963). J. Mol. Biol. 6, 306
a) El ligando implicado en la regulación de la actividad enzimática (molécula reguladora o
efector), generalmente, es estructuralmente diferente del sustrato o el producto de la reacción
que cataliza la enzima retroinhibida.
b) La mayor parte de las enzimas
cuya actividad se controla/regula
por este tipo de regulación, no
muestran cinéticas hiperbólicas
clásicas cuando se representa v
[S], sino que muestran una
cinética de tipo sigmoidal.
c) Es relativamente fácil distinguir entre la unión del efector a la enzima y la unión del sustrato.
Varios tratamientos químicos y físicos nos permiten “desensibizar” la enzima, es decir, hacerle
perder su respuesta ante las moléculas reguladoras o efectores sin que ello lleve parejo la perdida
de la actividad catalítica. Así en el caso de la ACTasa un tratamiento térmico, suave, da lugar a una
enzima activa no inhibible por CTP. La enzima “desensibizada” muestra una cinética hiperbólica
semejante a la que presentan las enzimas michaelianas.
d) Generalmente las enzimas que se regulan por este mecanismo son “oligómeros”, es decir,
proteínas formadas por varias subunidades iguales o distintas, unidas entre si por fuerzas débiles.](https://image.slidesharecdn.com/enzimasvov-120519203854-phpapp02/85/Enzimas-vo-v-16-320.jpg)