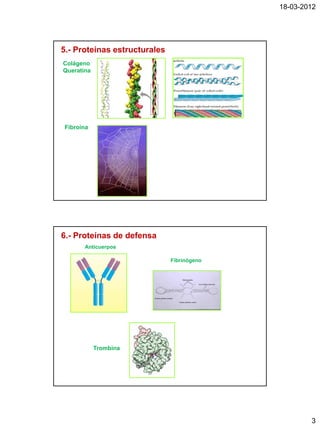
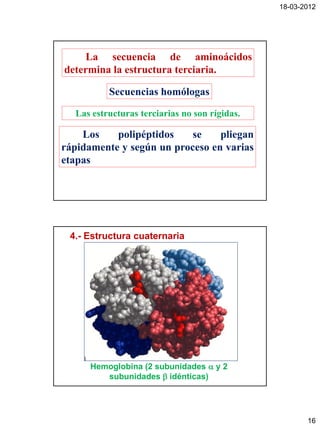
El documento clasifica las proteínas según su función biológica en 8 categorías, describe las modificaciones covalentes que experimentan las proteínas, y explica los 4 niveles de estructura de las proteínas (primaria, secundaria, terciaria y cuaternaria). Además, analiza factores que determinan la estructura secundaria y terciaria como la preferencia conformacional de aminoácidos.