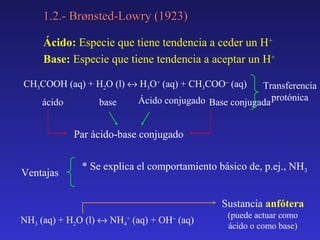
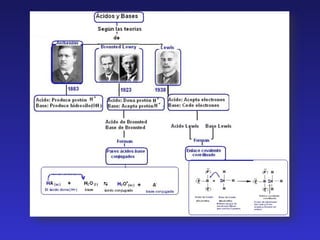
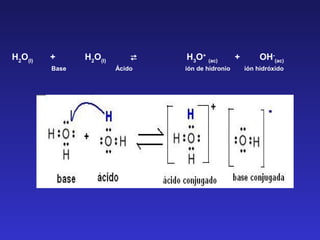
Este documento describe las funciones de los ácidos y bases en los alimentos y define ácidos y bases según diferentes teorías. Los ácidos cumplen funciones como intensificar el sabor y controlar el crecimiento microbiano, mientras que las bases se usan para modificar el color, sabor y textura. Arrhenius definió ácidos como sustancias que ceden H+ en agua y bases como las que ceden OH-. Brønsted-Lowry definieron ácidos como especies que ceden H+ y bases como las que lo aceptan, form








![CH3
COOH + H2
O (l)
H+
(ac)
+ CH3
COO-
(ac)
[ ]COOHCH
COOCHOH
Ka
3
33
−
+
=
[ ]3
4
NH
NHOH
Kb
+
−
=](https://image.slidesharecdn.com/equilibriooinico12015-150311185909-conversion-gate01/85/Equilibrio-oinico-1-2015-13-320.jpg)
![HF + H2
O H+
+ F-
[ ]HF
FH
Ka
−
+
=
H2
S + H2
O H+
+ S 2-
[ ]SH
SH
Ka
2
2
−
+
=
NH4
OH + H2
O NH4
+
+ OH-
[ ]OHNH
OHNH
Kb
4
4
−
+
=](https://image.slidesharecdn.com/equilibriooinico12015-150311185909-conversion-gate01/85/Equilibrio-oinico-1-2015-14-320.jpg)

![LA AUTOIONIZACIÓN DEL AGUA.LA AUTOIONIZACIÓN DEL AGUA.
ESCALA DE pH.ESCALA DE pH.
22
Equilibrio de autoionización del agua
H2O (l) + H2O (l) ↔ H3O+
(aq) + OH−
(aq)
pH = − log [H3O+
]
pOH = − log [OH−
]
− log 10-14
= − log [H3O+
] − log [OH−
]
14 = pH + pOH
Kw = [H3O+
][OH−
]
Producto iónico del agua
A 25ºC, Kw = 10-14
[Tomando logaritmos y cambiando el signo]](https://image.slidesharecdn.com/equilibriooinico12015-150311185909-conversion-gate01/85/Equilibrio-oinico-1-2015-17-320.jpg)
![Søren Sørensen
(1868-1939) a los
41años de edad
propuso el término
de pH
El bioquímico danés Søren Sørensen propuso el término de pH
para indicar el potencial del ión hidrógeno. Definió el pH como el
logaritmo negativo de la concentración molar (M) de iones de
hidronio [H3O+
]. La fórmula del pH es:
pH= -log [H3O+
]
pH= -log [H+
]
Es importante que escribas correctamente el término de pH, con la
letra “p” en minúscula y la letra “H” en mayúscula. De lo contrario
es incorrecto. Recuerda que la excelencia académica comienza
por ti.
Como has notado, las concentraciones de estos iones de
hidronio (H3
O+
), suelen expresarse en números muy pequeños
en notación exponencial, debido a esto:](https://image.slidesharecdn.com/equilibriooinico12015-150311185909-conversion-gate01/85/Equilibrio-oinico-1-2015-18-320.jpg)
![Agua pura: [H3O+
] = [OH−
] ; [H3O+
] = 10-7
⇒ pH = 7
[OH−
] = 10-7
⇒ pOH = 7
DISOLUCIÓN
NEUTRA
[H3O+
] = [OH−
]
pH = 7
DISOLUCIÓN
ÁCIDA
[H3O+
] > [OH−
]
pH < 7
DISOLUCIÓN
BÁSICA
[H3O+
] < [OH−
]
pH > 7
pH
7
ácida básica](https://image.slidesharecdn.com/equilibriooinico12015-150311185909-conversion-gate01/85/Equilibrio-oinico-1-2015-19-320.jpg)
![En una disolución de NaOH, con una concentración
de [OH-
] es 3,4 x10-4
M. Calcule el pH de la disolución
En una disolución de HCl, con una concentración de 0,1 M.
Calcule el pH de la disolución
Calcular el pH y pOH de una disolución de hidróxido de
calcio Ca(OH)2
con una concentración de 0,03 M.
Calcular el pH y todas las especies en equilibrio de una disolución de
ácido acético (CH3COOH) al 0,100 M. y una Ka de 1,8x10-5
CH3COOH + H2O H+
+ CH3COO-
Calcule el pH y las concentraciones de todas las
especies en equilibrio de una disolución de amoniaco
(NH3) al 0,40 M con Kb=1,8x10-5
Calcular la concentración de iones de hidronio [H3
O+
], de los siguientes pH:
•pH 8 pH 10,9](https://image.slidesharecdn.com/equilibriooinico12015-150311185909-conversion-gate01/85/Equilibrio-oinico-1-2015-20-320.jpg)

![Ionización del ácidos
dipróticos
Ácido carbónico
H2CO3
Acido débil
Contante de equilibrio (K)
Donde las ()indican como de
costumbre la reversibilidad de ambas
reacciones (equilibrio químico)
1er ionización Primera ionización Ka1 primera ionización
H2 X H+
+ HX-
H2CO3 H+
+ HCO3
-
2da ionización Segunda ionización Ka2 de la segunda ionización
HX-
H+
+ X=
HCO3
-
H+
+ CO3
2-
[ ]
71024
32
3
1
−=
−
+
= x,
COH
HCOH
Ka
111084
3
2
3
2
−=
−
−
+
= x,
HCO
COH
aK](https://image.slidesharecdn.com/equilibriooinico12015-150311185909-conversion-gate01/85/Equilibrio-oinico-1-2015-22-320.jpg)