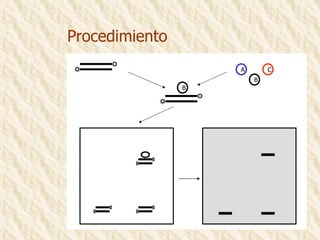
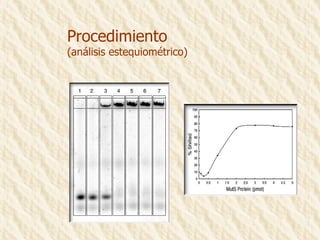
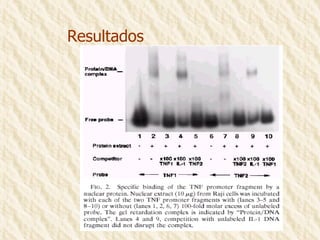
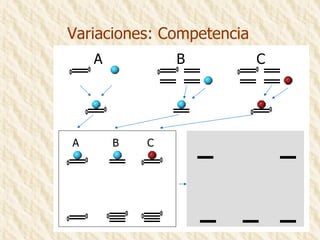
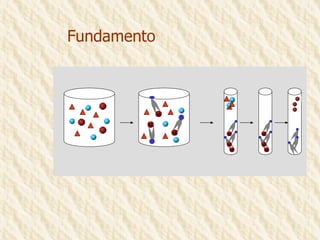
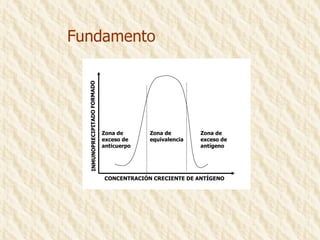
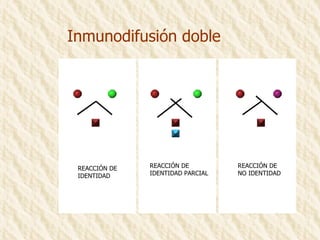
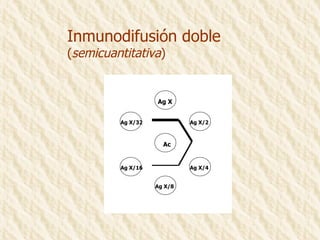
Este documento describe la técnica de gel de retardamiento de movilidad (mobility shift assay), la cual se utiliza para identificar proteínas que se unen al ADN. Esta técnica involucra marcar una sonda de ADN radiactivamente, incubarla con extractos proteicos, y luego separar los complejos ADN-proteína del ADN libre mediante electroforesis en gel de poliacrilamida. Esto permite identificar las proteínas que se unen específicamente a la secuencia de ADN de la sonda. El documento también cubre variaciones de esta
![Gel de retardamiento (mobility shift assay) Dr. en C. Erwin Chiquete Medicina Interna Biología Molecular en Medicina [email_address]](https://image.slidesharecdn.com/erwin-bandshift-111116010025-phpapp02/75/Erwin-band-shift-1-2048.jpg)