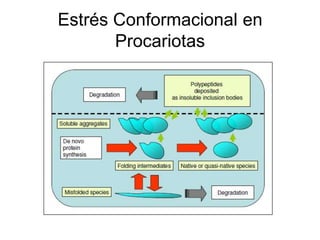
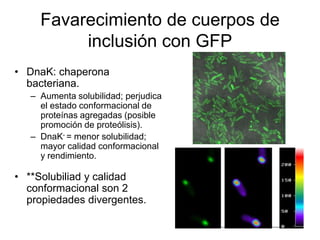
El documento analiza los desafíos en la producción de proteínas recombinantes in vivo, destacando el estrés conformacional causado por la sobreexpresión de proteínas extrañas en células huésped. Se discuten factores ambientales como la temperatura, oxigenación, osmolaridad y pH que influyen en el plegamiento de proteínas, así como las respuestas celulares como la respuesta a proteínas desplegadas y el aumento de producción bajo condiciones controladas. Se concluye que es fundamental entender las necesidades fisiológicas de las células para mejorar la producción y calidad de las proteínas expresadas heterológicamente.