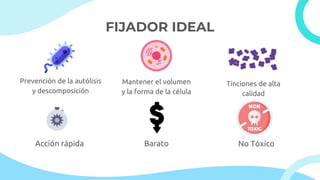
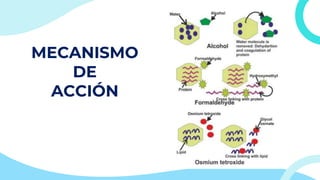
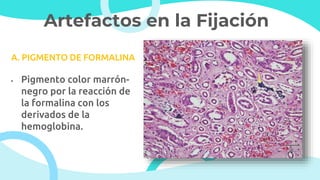
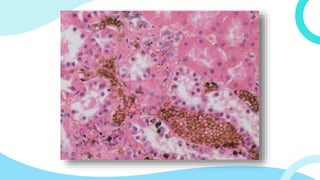
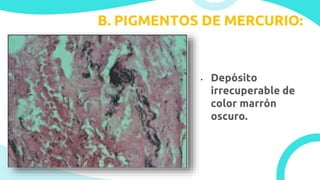
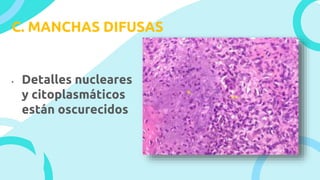
El documento describe los principios y métodos de la fijación de tejidos para su análisis microscópico. La fijación química fija las células en un estado físico y químico que resiste cambios morfológicos y descomposición. El formaldehído es el fijador más común debido a su bajo costo, fácil preparación y capacidad para conservar la morfología celular. Otros fijadores como glutaraldehído y tetróxido de osmio se usan para microscop